
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法不正确的是( )
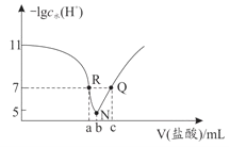
A.常温下,Kb(NH3·H2O)约为1×10-5
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积不相等
【答案】C
【解析】
还没滴HCl时,溶质为:NH3·H2O,抑制水的电离,c水(H+)﹤10-7,-1gc水(H+)>7;NH3·H2O和HCl反应生成NH4Cl和H2O,二者恰好完全反应时溶质为:NH4Cl,促进水的电离,水的电离程度最大,对应N点;所以R点溶质为:NH4Cl和NH3·H2O,Q点溶质为:NH4Cl和HCl,据此分析解答。
A.V(HCl)=0时,溶质为NH3·H2O,此时溶液中的H+全都是由水电离的,所以-1gc(H+)=-1gc水(H+)=11,即c(H+)=10-11,c(OH-)=![]() =10-3mol/L,所以Kb(NH3·H2O) =
=10-3mol/L,所以Kb(NH3·H2O) =![]() =
=![]() ,A正确;
,A正确;
B.b=20mL时,HCl的物质的量= NH3·H2O的物质的量,NH3·H2O和HCl恰好完全反应,溶质为NH4Cl,促进水的电离,水的电离程度最大,-1gc水(H+)最小,B正确;
C.R点溶质为:NH4Cl和NH3·H2O,水的电离程度不促进也不抑制,说明该点NH4Cl的水解程度和NH3·H2O的电离程度相等,显中性,Q点溶质为:NH4Cl和HCl,一定显酸性,C错误;
D.R到N,一方面滴加HCl消耗了NH3·H2O的抑制作用,另一方面生成的NH4Cl还直接起到促进水的电离的作用,N到Q,仅仅HCl起到抑制作用,但是R点和Q点水的电离程度是相等的,那么必然有R到N的HCl的体积小于N到Q所加盐酸体积,D正确。
答案选C。


科目:高中化学 来源: 题型:
【题目】利用下图所示装置可确定有机物的化学式,其原理:在玻璃管内,用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
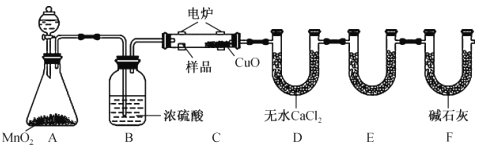
回答下列问题:
(1)装置B中的作用是____________________;若无B装置,则会造成测得的有机物中含氢量_________(填“偏大”“偏小”或“不变”)。
(2)装置E中所盛放的试剂是________ ,其作用为______________ 。
(3)若准确称取1.20g有机物(只含C、H、O 三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为_______________。
(4)要确定该有机物的分子式,还需要测定_________________ 。
(5)若该有机物的相对分子质量为60,核磁共振氢谱中有2组峰且面积比为3:1,则该有机物可能为乙酸或________ (填名称),可采取_______ 方法(填一种仪器分析法)确定该有机物具体是何种物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.Fe(OH)3 溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B.K2S 溶液中加入AgCl 固体反应的离子方程式为:2AgCl+S2-===2Cl-+Ag2S
C.苯酚钠溶液中通入少量二氧化碳: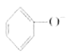 +CO2+H2O→
+CO2+H2O→![]() +CO32-
+CO32-
D.溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A.过量的铁在1molCl2中然烧,最终转移电子数为2NA
B.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.1L1mol/LNaF溶液中F-的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯乙烯是一种重要的有机化工原料,某化学小组利用如图装置制备氯乙烯,下列有关说法错误的是
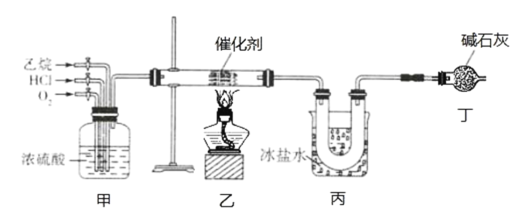
A.装置乙中发生反应的化学方程式为:CH3CH3+HCl+O2![]() CH2=CHCl+2H2O
CH2=CHCl+2H2O
B.装置甲可通过控制通入气体的速率来控制反应气体的物质的量之比
C.装置丙的主要作用为冷凝并分离出氯乙烯
D.装置丁可以完全吸收尾气,实现尾气零排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用硫酸酸化的高锰酸钾溶液与草酸溶液反应测定单位时间内生成CO2的量来探究影响反应速率的因素。设计实验方案如表:
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
(1)图1装置中盛放A溶液的仪器名称是_____,检验如图1装置气密性的方法为_____。

(2)硫酸酸化的高锰酸钾溶液与草酸溶液反应的化学反应方程式为_____。
(3)此实验探究的是_____因素对化学反应速率的影响,若实验②在40s末收集了22.4mLCO2(标准状况下),则在40s内,v(MnO4-)=_____(忽略溶液混合前后体积的变化)。
(4)小组同学将图1的气体收集装置改为图2,实验完毕冷却后,读数时发现量气管液面高于干燥管液面,为得到准确数据,采取的操作是:____。
(5)除了通过测定单位时间内生成CO2的体积来比较反应速率,本实验还可以通过测定____来比较化学反应速率。
(6)同学们在实验中发现反应速率总是如图3所示,探究t1~t2时间内速率变快的主要原因可能是:____。
A.该反应放热 B.生成的Mn2+起催化作用 C.K2SO4浓度增大

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,回答下列小题
将一定比例的三氧化硫和水混合可制得硫酸。硫酸是一种重要的化工原料,用途十分广泛,除用于化学工业外,还非常广泛应用于肥料、非碱性清洁剂、护肤品、油漆添加剂与炸药的制造等方面。
【1】关于浓硫酸的说法正确的是
A.易挥发
B.见光分解
C.密度比水的小
D.常温下能使铝片钝化,浓硫酸作氧化剂
【2】稀硫酸可以用于实验室制氢气,反应方程式为Zn+H2SO4=ZnSO4+H2↑,该反应的反应类型说法正确的是
A.化合反应B.复分解反应C.置换反应D.分解反应
【3】在其他条件不变的情况下,欲提高硫酸与锌反应产生氢气的速率,可以采用的措施有
A.选用颗粒更大的锌粒
B.升高反应温度
C.用98%浓硫酸来代替稀硫酸反应
D.加入硫酸钾溶液
【4】下列反应中,生成物总能量高于反应物总能量的是
A.S+O2![]() SO2
SO2
B.CaO+H2O=Ca(OH)2
C.C+CO2![]() 2CO
2CO
D.Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有容积均为2 L的甲、乙恒容密闭容器,向甲中充入1.5 mol CO2和3 mol H2,乙中充入2 mol CO2、3 mol H2,一定条件下仅发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),实验测得反应体系中CO2的平衡转化率与温度的关系曲线如图所示。下列说法正确的是
CH3OH(g)+H2O(g),实验测得反应体系中CO2的平衡转化率与温度的关系曲线如图所示。下列说法正确的是

A.该反应的ΔH>0
B.曲线Ⅱ表示甲容器中CO2的平衡转化率与温度的关系
C.500 K时,该反应的化学平衡常数为200
D.700 K时,若在上述密闭容器中充入0.9 mol CO2、1.2 mol H2、0.1 mol CH3OH、0.1mol H2O,则达到平衡时,H2的体积分数大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的 Cr、Fe、Co、Ni、Cu、Zn 等许多金属能形成配合物。
(1)NH3 是一种很好的配体,氨气分子是_____(填“极性”或“非极性”)分子,NH3 的沸 点_____(填“高于”“等于”或“低于”)AsH3。
(2)科学家通过 X 射线测得胆矾的结构示意图可简单表示如下:

图中虚线表示的作用力为_________________________。
(3)胆矾溶液与氨水在一定条件下可以生成 Cu(NH3)4SO4H2O 晶体。在 Cu(NH3)4SO4·H2O 晶体中,含 有的原子团或分子有:[Cu(NH3)4]2+、NH3、 SO42 、H2O,[Cu(NH3)4]2+为平面正方形结构,则 VSEPR 模型为四面体结构的原子团或分子是_____________,其中心原子的杂化轨道类型是________________ 。
(4)金属镍粉在 CO 气流中轻微加热,生成无色挥发性液态 Ni(CO)4,呈正四面体构型。Ni(CO)4 易溶于_____________________ (填编号)。
a . 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com