
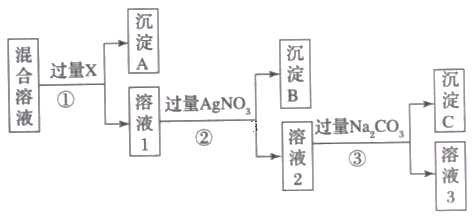
����Ŀ�����к�NaCl��Na2SO4��NaNO3�Ļ����Һ��ѡ���ʵ����Լ���ȥ��Һ�е�NaCl��Na2SO4���Ӷ��õ�������NaNO3��Һ����Ӧ��ʵ����̿�����ͼ��ʾ��
��ش��������⣺
(1)�Լ�X����� ___________________(�ѧʽ)������X�Ƿ��������ķ�����____________��
(2)д����������Ӧ�����ӷ���ʽ��_______________________________________ ��д����������Ӧ�����ӷ���ʽ��____________________________________________ ��
(3)����ʵ�鷽���õ�����Һ3�п϶�����____________���ѧʽ����ͬ)������Ϊ�˳�ȥ�����ʣ���������Һ3�м��������____________��֮����Ҫ��ô�NaNO3���壬������е�ʵ�������_______________________________�����������)��
���𰸡�Ba(NO3)2 ��Һ���÷ֲ㣬�����μ�Ba(NO3)2 �����������ɣ���˵��Ba(NO3)2 �Ѿ�����������û�й��� Ag++Cl-��AgCl�� Ba2++CO32-=BaCO3����2Ag++CO32-=Ag2CO3�� Na2CO3 HNO3 ����
��������
������ͼ�Ͽ����ڢٲ�����ӦΪ��ȥ��Һ�е�SO42-����ʱ��Һ��������Ba2+���ڢڲ���������AgNO3��ӦΪ��ȥ��Һ�е�Cl-����ʱ��Һ��������Ag+���ڢ۲���������Na2CO3��ӦΪ��ȥ������Ba2+��Ag+����������CO32-��
(1)�Լ�XҪ�����ȳ���SO42-���־����ܲ������µ����ʣ�����ӦΪ�����Σ�����X�Ƿ��������ķ����Ǽ�������X�����Ƿ����ɳ�����
(2)�����������������Ȼ��Ƶ����ӷ�Ӧ����������Na2CO3��Ba2+��Ag+�ķ�Ӧ��
(3)����ʵ�鷽���õ�����Һ3�п϶�����Na2CO3������Ϊ�˳�ȥ�����ʣ���������Һ3�м�����������ᣬ֮����Ҫ��ô�NaNO3���壬������е�ʵ������Ǵ���Һ����ȡ���ʡ�
(1)�Լ�X�����Ba(NO3)2����Ϊ���ܱ�֤����SO42-�����ܱ�֤����������������ӡ�����X�Ƿ��������ķ����ǣ���Һ���÷ֲ㣬�����μ�Ba(NO3)2�����������ɣ���˵��Ba(NO3)2�Ѿ�����������û�й�����
�𰸣�Ba(NO3)2����Һ���÷ֲ㣬�����μ�Ba(NO3)2�����������ɣ���˵��Ba(NO3)2 �Ѿ�����������û�й�����
(2)�����ΪNaCl��AgNO3�ķ�Ӧ����Ӧ�����ӷ���ʽ��Ag++Cl-��AgCl��������۷���������Ӧ��һ���ǹ�����Ba2+��CO32-�ķ�Ӧ����һ����Ag+��CO32-�ķ�Ӧ����Ӧ�����ӷ���ʽΪBa2++CO32-=BaCO3����2Ag++CO32-=Ag2CO3����
�𰸣�Ag++Cl-��AgCl����Ba2++CO32-=BaCO3����2Ag++CO32-=Ag2CO3����
(3)����ʵ�鷽������Ϊ�����Na2CO3���������Եõ�����Һ3�п϶�����Na2CO3������Ϊ�˳�ȥ�����ʣ���������Һ3�м��������HNO3��֮����Ҫ��ô�NaNO3���壬������е�ʵ�������������
�𰸣�Na2CO3��HNO3��������


 �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100 mL 0.3 mol��L��1 Na2SO4��Һ��50 mL 0.2 mol��L��1 Al2(SO4)3��Һ��Ϻ���Һ��SO42-�����ʵ���Ũ��Ϊ(����)
A. 0.20 mol��L��1B. 0.25 mol��L��1
C. 0.40 mol��L��1D. 0.50 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ʳ�������ӽ϶���ǵ����(KIO3)��������ڹ�ҵ�Ͽ��õ�ⷨ��ȡ����ʯī�Ͳ����Ϊ�缫���ϣ���KI��ҺΪ���Һ����һ�������½��е�⣬��Ӧ�Ļ�ѧ����ʽΪKI��3H2O![]() KIO3��3H2���������й�˵������ȷ����
KIO3��3H2���������й�˵������ȷ����
A. �ӵ�ʳ�β���ʹ������Һ����
B. ���ʱ��ʯī�������������������
C. �����ĵ缫��ӦʽΪI-+3H2O+6e-=IO3-+6H��
D. ת��3 mol���ӣ������Ͽ��Ƶ�107 g KIO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Z�Ǻϳ�ƽ��ҩɳ���������м��壬��ͨ������·���Ƶã�

����˵����ȷ����(����)
A. X����������ԭ����ͬһƽ����
B. Y������H2�ļӳɲ����������2������̼ԭ��
C. ����FeCl3��Һ����Y��Z
D. 1 mol Z�������2 mol NaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij˫ԭ�ӷ��ӹ��ɵ����壬��Ħ������ΪM g��mol��1�������ӵ�����ΪNA��������Ϊm g�ĸ����壬���ú�M��NA��m���ŵ�ʽ�ӱ�ʾ����
(1)�ڱ�״���£�����������Ϊ________L���ܶ�Ϊ________g��L��1��
(2)������������ԭ������Ϊ________����
(3)�������һ�����ӵ�����ԼΪ________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ĩ��Ʒ�п��ܺ���SiO2��Fe2O3��CaO��CuO��MgO��Na2O��̿�۵ȳɷ֣�Ϊȷ�����е���֣�ijͬѧ��Ʋ����������ʵ�飺
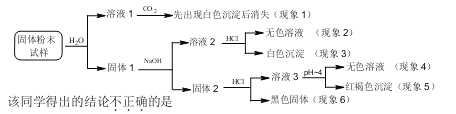
A��������1��3���ƶ���Ʒ����CaO��û��Na2O
B��������3���ƶ���Ʒ����SiO2
C��������4��5���ƶ���Ʒ����Fe2O3��MgO
D��������4��6���ƶ���Ʒ����̿�ۣ���CuO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
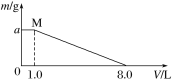
����Ŀ����FeCl3��CuCl2�����Һ����һ�������������г�ַ�Ӧ�����ӻ����Һ������뷴Ӧ��ʣ�����������ͼ��ʾ����֪ԭ�����Һ��Cu2��Ũ��Ϊ0.140 mol��L��1�������M��ʱ��Һ����Cu2����
��1��c(FeCl3)��______mol��L��1��
��2�����۵�����Ϊ____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���α������һ������Ѫ�����ŵĽ�Ѫѹҩ�һ�ֺϳ��α�����м���G�IJ����������£�
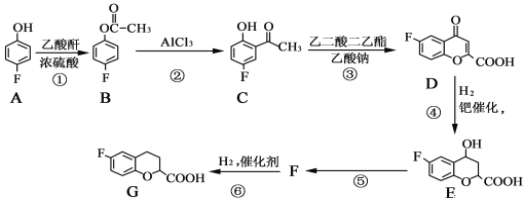
��֪���������Ľṹ��ʽΪ![]()
��ش��������⣺
(1)A��������___________��B�����������ŵ�������___________��
(2)��Ӧ�ݵĻ�ѧ����ʽΪ______________________���÷�Ӧ�ķ�Ӧ������___________��
(3)G�ķ���ʽΪ___________��
(4)д����������������E��ͬ���칹��Ľṹ��ʽ��___________��___________��
I.������ֻ������ȡ����
��˴Ź�������ͼ��ֻ��4�����շ�
��.1mol������������ NaHCO3��Һ��Ӧ����2 mol CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������C9H10O2������ˮ����ζ������������ˮ�㾫�����쾫�ͣ���������ʳƷ��ҵ�У�Ҳ�������л��ϳ��м��塢�ܼ��ȣ����Ʊ�����Ϊ��
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
��֪��
��ɫ��״̬ | �е㣨�棩 | �ܶȣ�gcm��3�� | |
������* | ��ɫƬ״���� | 249 | 1.2659 |
���������� | ��ɫ����Һ�� | 212.6 | 1.05 |
�Ҵ� | ��ɫ����Һ�� | 78.3 | 0.7893 |
������ | ��ɫ����Һ�� | 80.8 | 0.7318 |
*��������100���Ѹ��������ʵ�鲽�����£�
����Բ����ƿ�м���12.20g�����ᡢ25mL�Ҵ�����������20mL�����飬�Լ�4mLŨ���ᣬ��Ͼ��Ȳ������ʯ������ͼ��ʾװ�������������¶���6570����Ȼ���2h����Ӧʱ������һ�Ҵ���ˮ���γɡ���������е�62.6�棩��������������÷�ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��������������Ҵ���
�ڷ�Ӧ�������������ų���ˮ����Һ��ر��������������ȣ�����ˮ�����ռ�����Һ�岻���������ӣ�ֹͣ���ȣ�
�۽���ƿ�ڷ�ӦҺ����ʢ������ˮ���ձ��У���������Na2CO3����Һ�����ԣ�
���÷�Һ©���ֳ��л��㣬ˮ����25mL������ȡ��Һ��Ȼ��ϲ����л��㣮�����Ȼ��ƣ��Դֲ����������װ����ͼ��ʾ���������������Ѻ������£�����210213�����֣�
�ݼ���ϸ�ò�Ʒ���Ϊ13.16mL��
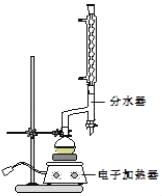
��1���ڸ�ʵ���У�Բ����ƿ���ݻ����ʺϵ���_____��������ȷѡ��ǰ����ĸ����
A.25mL B.50mL C.100mL D.250mL
��2��������з�ʯ��������____��ʹ�÷�ˮ�����Ϸ����ȥˮ��Ŀ����_____��
��3�������Ӧ������ֵ��¶���__��
A.215220�� B.8590�� C.7880�� D.6570��
��4������ۼ���Na2CO3��������________����Na2CO3���벻�㣬��֮������ʱ��������ƿ�пɼ����������ɣ������������ԭ����________��
��5�����ڲ�����е���ȡ��Һ����������ȷ����____��
A��ˮ��Һ�м������ѣ�ת������Һ©���У����ϲ���������Һ©����ת������������ҡ
B����ҡ���κ����Һ©���¿ڵIJ���������
C����������ҡ���������ֳַ�Һ©�����ô�Һ��ֲ�
D���ų�Һ��ʱ��Ӧ���Ͽڲ������������ϵİ��۶�©�����ϵ�С��
��6�����㱾ʵ��IJ���Ϊ____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com