
【题目】已知:A是石油裂解气的主要成份,能使溴水褪色;A是一种重要的化工原料,它的产量通常用来衡量一个国家石油化工水平.现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示:

请回答下列问题:
(1)写出A的电子式 .
(2)B、D分子中的官能团名称分别是 、 .
(3)写出下列反应的化学方程式并指出反应类型:
① 反应类型 ;
② 反应类型 ;
④ 反应类型 。
⑤ 反应类型 。
【答案】(1)![]() ; (2)羟基,羧基;
; (2)羟基,羧基;
(3)①CH2=CH2+H20![]() CH3CH2OH;加成反应;
CH3CH2OH;加成反应;
②2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;氧化反应.
2CH3CHO+2H2O;氧化反应.
④CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 取代反应
CH3COOCH2CH3+H2O 取代反应
⑤![]() 加聚反应
加聚反应
【解析】
试题分析:A是石油裂解气的主要成份,能使溴水褪色,A是一种重要的化工原料,它的产量通常用来衡量一个国家石油化工水平,所以A是乙烯,乙烯和水发生加成反应生成B,则B是乙醇,乙醇和氧气反应生成C,则C是乙醛,C和氧气反应生成D,D是乙酸,乙醇和乙酸反应生成乙酸乙酯,以A为主要原料合成高分子化合物E,则E是聚乙烯。
(1)由上述分析可知,A为乙烯,电子式为![]() ;
;
(2)B是乙醇,含有羟基,D是乙酸,含有羧基;
(3)反应①是乙烯与水发生加成反应生成乙醇,方程式为:CH2=CH2+H20![]() CH3CH2OH;
CH3CH2OH;
反应②是乙醇在催化剂作用下发生氧化反应生成乙醛,反应方程式为:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
反应④是乙醇和乙酸发生酯化反应生成乙酸乙酯,反应方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+ H2O。
CH3COOCH2CH3+ H2O。
反应⑤是乙烯发生加聚反应生成聚乙烯,化学方程式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加________后加________,原因是______________________。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂,则水中的Ca2+、Mg2+与交换树脂的________起离子交换作用。若使用NaR作为阳离子交换树脂,失效后可放入5%~8%________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO等离子,电极为惰性电极。请分析下列问题:
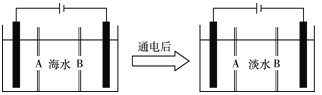
① 阳离子交换膜是指________(填A或B)。
②写出通电后阳极区的电极反应式:__________;阴极区的现象是:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A. ①③ B. ①④ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.虽然油脂的相对分子质量都较大,但油脂不属于高分子化合物
B.淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
C.酯化反应属于取代反应
D.乙烯使酸性高锰酸钾溶液褪色与乙烯使溴水褪色的原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
B. 0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1 NA
C. 反应3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92 kJ/mol,放出热量9.2 kJ时,转移电子0.6 NA
2NH3(g) ΔH=-92 kJ/mol,放出热量9.2 kJ时,转移电子0.6 NA
D. 0.1 mol H2O2分子中含极性共价键数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 同周期元素的原子半径以ⅦA族的为最大
B. 在周期表中0族元素的单质全部是气体
C. ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子,第一电离能越大
D. 所有主族元素的原子形成单核离子时的价数都和它的族数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明强酸性溶液,可能含K+、NH4+、Al3+、Cu2+、Fe2+、SO42-、SiO32-、CO32-、NO3-等离子中的若干种,现做如下实验:
①取少量该溶液,加入足量用稀硝酸酸化的BaCl2溶液,有白色沉淀生成。
②另取①中上层澄清溶液,加入氢氧化钠溶液,生成沉淀的物质的量随NaOH溶液的体积变化的图象如下所示。
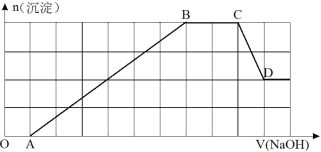
请完成下列问题:
(1)原溶液中一定存在(H+、OH-不必写出)___________,一定不存在________________,可能存在____________。
(2)原溶液中肯定含有的阳离子(H+除外)物质的量之比为________________。
(3)步骤①中若有氧化还原反应请写出对应离子方程式(若无,填写“无”)________________。
(4)若已知步骤②中最终形成1mol沉淀。现取原溶液加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com