
����Ŀ��ʵ���һ������÷Ͼ�����ӵ��������������ﮣ�LiMn2O4����һ���������£�
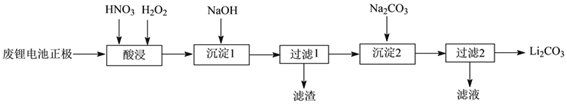
��1���Ͼɵ�ؿ��ܲ����е���ﮣ���ⲻ���ױ�ը���Ż�Ϊ�˰�ȫ���Բ�����Ҫ����_________��
��2���������ʱ����HNO3��H2O2�Ļ��Һ�壬�ɽ����ܵ�LiMn2O4ת��ΪMn(NO3)2��LiNO3�Ȳ����д���÷�Ӧ���ӷ���ʽ_________��
������������ܽ⣬�ӷ�Ӧ����ĽǶȷ��������������HNO3��H2O2������ȱ����_________��
��3��������2��ʱ��ϴ��Li2CO3�����IJ�����_________��
��4���ѷ�����̼���������������ַ�ĩ�������ʵ���1��4��Ͼ��ȼ��ȿ���������LiMn2O4�����µ�515��ʱ����ʼ��CO2������ͬʱ���ɹ���A����Ԥ��̼��﮵ķֽ��¶ȣ�723�棩�ͺܶ࣬���ܵ�ԭ����________��
��5���Ʊ��ߴ�MnCO3���壺��֪MnCO3������ˮ���Ҵ�����ʪʱ�ױ�����������100�濪ʼ�ֽ⣻Mn(OH)2��ʼ������pH=7.7���벹�������������У��Ƶõ�Mn(OH)2�Ʊ��ߴ�MnCO3�IJ�������[ʵ���п�ѡ�õ��Լ���H2SO4��Na2CO3��C2H5OH]����Mn(OH)2�б߽������_________��
���𰸡�����������ˮ��2LiMn2O4+10H++3H2O2=2Li++4Mn2++3O2��+8H2O��Ӧ����Cl2����Ⱦ�������Ų�������������м�������ˮ����û��������ˮ��Ȼ�������ظ�����2~3��MnO2��Ϊ������������̼��﮵ķֽ��¶�H2SO4��Һ�������ܽ⣬����Na2CO3����������ҺpH��7.7�����ˣ����������Ҵ�ϴ�ӣ�����100����ո���
��������
�����ԷϾ������������������﮵���������Ϊ���壬�������̵ķ��������ӷ���ʽ����д������ʵ������������Ʊ�ʵ�鷽������ơ��������ʱ����HNO3��H2O2�Ļ��Һ�壬�ɽ����ܵ�LiMn2O4ת��ΪMn��NO3��2��LiNO3�Ȳ��������1������NaOH��Mn��NO3��2ת���ɳ�����������2������Na2CO3��Li+�γ�Li2CO3������
��1��Li������е�O2��ˮ��Ӧ��
��2��HNO3��H2O2�Ļ��Һ��LiMn2O4��ԭΪMn��NO3��2����H2O2��������O2�����������HNO3��H2O2�Ļ��Һ���������������ΪCl2��
��3��ϴ�ӵIJ��������Ų�������������м�������ˮ����û��������ˮ��Ȼ�������ظ����� 2~3 ����
��4��MnO2��Ϊ������������̼��﮵ķֽ��¶ȡ�
��5��������Ŀ�ṩ���Լ��������Ʊ�MnCO3��ԭ��Ϊ��Mn��OH��2+H2SO4=MnSO4+2H2O��MnSO4+Na2CO3=MnCO3��+Na2SO4��pH=7.7ʱ��ʼ�γ�Mn��OH��2����������Na2CO3����Mn2+ʱ����pH![]() 7.7������MnCO3���������ʺͻ�ѧ����ѡ��MnCO3�����ᴿ�ķ�����
7.7������MnCO3���������ʺͻ�ѧ����ѡ��MnCO3�����ᴿ�ķ�����
��1���Ͼɵ�ؿ��ܲ����е���ﮣ�﮻�ѧ���ʻ��ã�﮿�������е�O2��H2O��Ӧ���Բ���Ҫ����������������ˮ�֡�
��2���������ʱ����HNO3��H2O2�Ļ��Һ�壬�ɽ����ܵ�LiMn2O4ת��ΪMn��NO3��2��LiNO3�Ȳ�����LiMn2O4����ԭ��Mn��NO3��2����H2O2��������O2����Ӧ��1molLiMn2O4���뷴Ӧ�õ�3mol������1molH2O2ʧȥ2mol���ӣ����ݵ�ʧ�����غ��ԭ���غ㣬��Ӧ�Ļ�ѧ����ʽΪ2LiMn2O4+10HNO3+3H2O2=2LiNO3+4Mn��NO3��2+3O2��+8H2O����Ӧ�����ӷ���ʽΪ2LiMn2O4+10H++3H2O2=2Li++4Mn2++3O2��+8H2O�������������ܽ⣬��������ԭ����������Cl2�����������HNO3��H2O2������ȱ���ǣ���Ӧ����Cl2����Ⱦ������
��3��������2��ʱ��ϴ��Li2CO3�����IJ����ǣ����Ų�������������м�������ˮ����û��������ˮ��Ȼ�������ظ����� 2~3 ����
��4����������̼�����MnO2�����ʵ���1:4��Ͼ������µ�515��ʱ����ʼ��CO2��������Ԥ�Ƶ�̼��﮵ķֽ��¶ȵͺܶ࣬���ܵ�ԭ���ǣ�MnO2��Ϊ������������̼��﮵ķֽ��¶ȡ�
��5��������Ŀ�ṩ���Լ��������Ʊ�MnCO3��ԭ��Ϊ��Mn��OH��2+H2SO4=MnSO4+2H2O��MnSO4+Na2CO3=MnCO3��+Na2SO4��pH=7.7ʱ��ʼ�γ�Mn��OH��2����������Na2CO3����Mn2+ʱ����pH![]() 7.7���Ʊ�MnCO3�IJ���Ϊ����Mn��OH��2�м���H2SO4�������ܽ�ת��ΪMnSO4��Һ����MnSO4��Һ�м���Na2CO3����pH
7.7���Ʊ�MnCO3�IJ���Ϊ����Mn��OH��2�м���H2SO4�������ܽ�ת��ΪMnSO4��Һ����MnSO4��Һ�м���Na2CO3����pH![]() 7.7���MnCO3������������MnCO3������ˮ���Ҵ�����ʪʱ�ױ�����������100�濪ʼ�ֽ���������Ϊ�˼���MnCO3���������ʺͷֽ⡢�Լ��ܽ���ʧ�����˷����MnCO3�����Ҵ�ϴ�ӣ��ڵ���100����ո����Mn��OH��2�Ʊ��ߴ�MnCO3�IJ�������Ϊ����Mn��OH��2�б߽������H2SO4��Һ�������ܽ⣬���� Na2CO3����������Һ pH��7.7�����ˣ����������Ҵ�ϴ�ӣ����� 100����ո�����
7.7���MnCO3������������MnCO3������ˮ���Ҵ�����ʪʱ�ױ�����������100�濪ʼ�ֽ���������Ϊ�˼���MnCO3���������ʺͷֽ⡢�Լ��ܽ���ʧ�����˷����MnCO3�����Ҵ�ϴ�ӣ��ڵ���100����ո����Mn��OH��2�Ʊ��ߴ�MnCO3�IJ�������Ϊ����Mn��OH��2�б߽������H2SO4��Һ�������ܽ⣬���� Na2CO3����������Һ pH��7.7�����ˣ����������Ҵ�ϴ�ӣ����� 100����ո�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. ������ˮ��Ӧ��Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. ��ⱥ��CuCl2��Һ��Cu2++2Cl-+2H2O![]() Cu(OH)2��+H2��+Cl2��
Cu(OH)2��+H2��+Cl2��
C. ����������Һ�м����������Ba2++OH-+NH4++SO42-=BaSO4��+NH3��H2O
D. ̼�������Һ�м�������ʯ��ˮ��Ca2++2HCO3-+2OH-=CaCO3��+2H2O+CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������л�ѧ������������ȷ���У�������
A.��������ͷ��Ϳ������
B.��֬ˮ������ղ���Ϊ������
C.���Ͳ�˿����Ҫ�ɷֶ�����ά��
D.����Ʒ�е���ҪӪ�������ǵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����λ�ڢ�A�壬���Ȼ���BCl3����������ȡ�����飨B2H6����Ҳ�����л��ϳɵĴ�����
�������ϣ���BCl3�ķе�Ϊ12.5�棬�۵�Ϊ-107.3�棻��![]() ��������������������Һ��Ӧ�������������ƣ���
��������������������Һ��Ӧ�������������ƣ���
���ʵ�飺ijͬѧ�����ͼ��ʾװ�����������͵�����Ӧ�Ʊ����Ȼ���
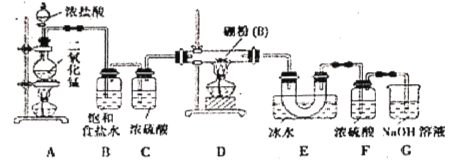
��1�������£�������ع����Ũ���ᷴӦ���Դ���Aװ���еķ�Ӧ����д��������ع�����Ũ���ᷴӦ�����ӷ���ʽ___________________________________��
��2��Eװ�õ�������______________________�������ȥBװ�ã����ܺ����___________________��
��3��ʵ���п�����һ��ʢװ____________�����Լ����ƣ��ĸ���ܴ���F��Gװ�ã�ʹʵ�����㡣
��4�����Ȼ�����ˮ���ҷ�Ӧ��������(H3BO3���Ͱ�����д���÷�Ӧ�Ļ�ѧ����ʽ��___________��
��5��Ϊ��˳�����ʵ�飬��ȷ�IJ�����_______(�����)��
���ȵ�ȼA���ƾ��ƣ����ȼD���ƾ��ƣ����ȵ�ȼD���ƾ��ƣ����ȻA���ƾ��ƣ���ͬʱ��ȼA, D���ƾ���
��6�����㲹����������ļ���ʵ�飬����֤�ƵõIJ�Ʒ���Ƿ�����ۣ�ȡ������Ʒ���Թ��У��μ�Ũ_________(�ѧʽ)��Һ���������ݲ���������Ʒ�к�����ۣ��������ݲ���������Ʒ������ۡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CPAE�Ƿ佺����Ҫ���Գɷ֣����ɿ�����ϳɣ��ϳɹ������£�����˵������ȷ���ǣ�������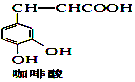 +
+ ![]() ��
�� 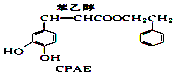 +H2O��
+H2O��
A.1molCPAE��1mol������ֱ���������NaOH��Һ��Ӧ�����������3molNaOH
B.�뱽�Ҵ���Ϊͬ���칹��ķ������ʹ���9��
C.FeCl3��Һ���������CPAE
D.������ɷ����ۺϷ�Ӧ������������к���3�ֹ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����������������أ�������������ȷ����
A.��·��������Ĵ���ˮ�������������ǽ�������
B.����ֲ������������ڳ��³�ѹ�°ѵ���ת��Ϊ���Ļ�����
C.�ں����ȼ���м���������ʯ�ң��Լ��ٶ���������ŷ���
D.����ˮ��ͨ����������ɱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������AG��ʾ��Һ����ȣ������ʽΪAG= 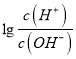 �����£�ʵ��������0.1mol/L������ζ�10mL0.1mol/LMOH��Һ���ζ�������ͼ��ʾ������˵����ȷ����
�����£�ʵ��������0.1mol/L������ζ�10mL0.1mol/LMOH��Һ���ζ�������ͼ��ʾ������˵����ȷ����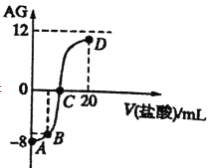
A. �õζ����̿�ѡ���̪��Ϊָʾ��
B. ��B�������������Ϊ5mL,������Һ��:c(M+)+2c(H+)=c(MOH)+2c(OH-)
C. ˮ�ĵ���̶�:A
D. MOH�ĵ���ƽ�ⳣ��Ϊ1��10-17
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ç��������ںϳ�ҩ���ƣ���ṹ��ʽ��ͼ�����й���ç�����˵����ȷ����
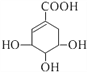
A. ç�������ʽΪC7H10O
B. ç��������к������ֹ�����
C. һ��������ç����ɷ���ȡ�����ӳɡ�������Ӧ
D. 1molç��������ܺ�4mol NaOH�����кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25��ʱ0.1molL��1�İ�ˮ����ش��������⣺
��1������ˮ�м�����������粒��壬һˮ�ϰ��ĵ���ƽ���ƶ�������������ҡ�����������ʱ��Һ��C��OH����/C��NH3H2O�������������С�����䡱����
��2������ˮ�м���ϡ��������Һ��pH=7����ʱC��NH4+��=a molL��1 �� ��C��SO42����= ��
��3������ˮ�м���ϡ���ᣬʹ��ǡ���кͣ�д����Ӧ�����ӷ���ʽ����
������Һ��pH7�����������������=�����������ӷ���ʽ��ʾ��ԭ�� �� ������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com