
【题目】可以用分液漏斗分离的一组化合物是 ( )
A. 硝基苯和水 B. 苯和溴苯 C. 酒精和乙醚 D. 溴乙烷和汽油
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】主链为4个碳原子的单烯烃共有4种同分异构体,则与这种单烯烃具有相同的碳原子数、主链也为4个碳原子的某烷烃有( )。
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3,充分搅拌后静置,最终所得晶体(Na2CO310H2O)的质量 ( )
A. 等于1.06g B. 大于1.06g而小于2.86g C. 等于2.86g D. 大于2.86g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分數) 与pH的关系如下图所示。

下列叙述正确的是
A. 新制的pH=1的氯水中,c(C13-)>c(HClO)>c(H+)
B. 新制氯水中持续通入SO2,pH不断变小,溶液颜色不断加深
C. 25℃时,HClO![]() H++ClO-的电离常数Ka的对数值为lgKa=-7.54
H++ClO-的电离常数Ka的对数值为lgKa=-7.54
D. pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为HClO+OH-=ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列叙述正确的是
A. 若V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,则V1≤V2
B. 等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数
C. 等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合:![]() <
<![]()
D. 将CH3COOH溶液与NaOH溶液混合,若混合后的溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),且溶液显酸性,则c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2会对环境和人体健康带来极大的危害,工业上采取多种方法来减少这些有害气体的排放。SO2的除去有如下两种方法:
方法1(双碱法): 用NaOH吸收SO2,并用CaO使NaOH再生:NaOH溶液![]() Na2SO3。
Na2SO3。
(1)写出过程①的离子方程式:_____________________。
(2)CaO在水中存在如下转化:CaO(s)+H2O(1)= Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理:___________________________。
Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理:___________________________。
方法2:用氨水除去SO2:
(3)已如25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=13×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol/L,溶液中的c(OH-)=______。将SO2通入该氨水中,当c(OH-)降为1.0×10-7mol/L时,溶液的c(SO32-)/c(HSO3-)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】化合物Ⅰ是有机合成中的一种重要中间体,具体合成过程如下(部分产物及条件略去):

①
②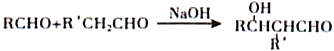
③![]()
④化合物A的一氯代物只有一种
(1)I分子中含有的官能团名称为________________________________。
(2)A→B的反应类型为__________________,G→H的反应类型为____________。
(3)D的化学名称为___________________________。
(4)C的结构简式为_________________,L的结构简式为_______________。
(5)G→J中过程①的化学方程式为_________________________,J→K的化学方程式为___________________________。
(6)同时满足下列条件的I的同分异构体有_________种(不考虑立体异构,不包括I)。
①与具有相同的官能团 ②具有六元碳环结构 ③分子中有一个甲基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种易挥发的液体,它是一种重要的化工原料,也是一种清洁能源。
(1)已知:①CO(g) + 2H2(g) ![]() CH3OH(l) ΔH=-128.1 kJ·mol-1
CH3OH(l) ΔH=-128.1 kJ·mol-1
②2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ·mol-1
③H2(g) + 1/2O2(g) = H2O(g) ΔH=-241.8 kJ·mol-1
④2CO(g) + O2(g) = 2CO2(g) ΔH=-566.0 kJ·mol-1
写出表示CH3OH燃烧热的热化学方程式:________________________________。
(2)不同温度下,将1.0 molCH4和2.4molH2O(g)通入容积为10 L的恒容密闭容器中发生如下反应: CH4(g)+ H2O(g) ![]() CO(g) + 3H2(g),测得体系中H2O的体积百分含量随着时间的变化情况如下图所示:
CO(g) + 3H2(g),测得体系中H2O的体积百分含量随着时间的变化情况如下图所示:
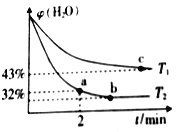
①T1____T2(填“>”“<”或“=”,下同),其对应的平衡常数K1____K2。
②温度T2下,从反应开始到2min时,ν(H2O)=___________。
③T1温度时,若已知到达平衡是H2O(g)的体积百分含量为40%,则该温度下上述反应的平衡常数K=____________。(保留两位小数点)
(3)科学家用氮化镓组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成了CH4。铜电极表面的电极反应式为__________________________。

(4)已知CO可与I2O5反应:5 CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。将甲醇不完全燃烧产生的500mL(标准状况)气体用足量的I2O5处理后,将所得的I2准确地配成100mL碘的酒精溶液。再取25.00mL该溶液加入淀粉溶液作指示剂后用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL(气体样品中其它成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)。
5CO2(g)+I2(s)。将甲醇不完全燃烧产生的500mL(标准状况)气体用足量的I2O5处理后,将所得的I2准确地配成100mL碘的酒精溶液。再取25.00mL该溶液加入淀粉溶液作指示剂后用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL(气体样品中其它成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)。
①滴定终点时溶液颜色变化为____________________________。
②气体样品中CO的体积分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。减少CO2排放是一项重要课题。
(1)以CO2为原料制取碳(C)的太阳能工艺如图所示。

①过程1中每生成1molFeO转移电子数为_______________。
②过程2中发生反应的化学方程式为___________________________。
(2)碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的新材料,用甲醇、CO、CO2在常压、70~120℃和催化剂条件下合成DMC。
已知:①CO的燃烧热为△H =﹣283.0 kJ·mol-1
②H2O(l)= H2O(g) △H = + 44.0 kJ·mol-1
③2CH3OH(g)+CO2(g)![]() CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+1/2O2(g)![]() CH3OCOOCH3 (g)+ H2O(l) △H =_______________。
CH3OCOOCH3 (g)+ H2O(l) △H =_______________。
(3)在密闭容器中按n(CH3OH):n(CO2)=2:1投料直接合成DMC,一定条件下,平衡时CO2的转化率如图所示,则:

①v(A)、v(B)、v(C)由快到慢的顺序为____________________;
②K(A)、K(B)、K(C)由大到小的顺序为___________________;
③下列能说明在此条件下反应达到平衡状态的是__________。
A.2v正(CH3OH)= v逆(CO2) B.CH3OH与CO2的物质的量之比保持不变
C.容器内气体的密度保持不变 D.各组分的物质的量分数保持不变
(4)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应II:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
为分析催化剂对反应的选择性,在1 L密闭容器中充入1 molCO2和2 mol H2,测得有关物质的物质的量随温度变化如图所示。

①该催化剂在较低温度时主要选择________(填“反应Ⅰ”或“反应II”)。520℃时,反应II的平衡常数K=___________(只列算式不计算)。
②用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图所示。b电极上的电极反应式为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com