
【题目】甲醇是一种易挥发的液体,它是一种重要的化工原料,也是一种清洁能源。
(1)已知:①CO(g) + 2H2(g) ![]() CH3OH(l) ΔH=-128.1 kJ·mol-1
CH3OH(l) ΔH=-128.1 kJ·mol-1
②2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ·mol-1
③H2(g) + 1/2O2(g) = H2O(g) ΔH=-241.8 kJ·mol-1
④2CO(g) + O2(g) = 2CO2(g) ΔH=-566.0 kJ·mol-1
写出表示CH3OH燃烧热的热化学方程式:________________________________。
(2)不同温度下,将1.0 molCH4和2.4molH2O(g)通入容积为10 L的恒容密闭容器中发生如下反应: CH4(g)+ H2O(g) ![]() CO(g) + 3H2(g),测得体系中H2O的体积百分含量随着时间的变化情况如下图所示:
CO(g) + 3H2(g),测得体系中H2O的体积百分含量随着时间的变化情况如下图所示:
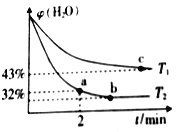
①T1____T2(填“>”“<”或“=”,下同),其对应的平衡常数K1____K2。
②温度T2下,从反应开始到2min时,ν(H2O)=___________。
③T1温度时,若已知到达平衡是H2O(g)的体积百分含量为40%,则该温度下上述反应的平衡常数K=____________。(保留两位小数点)
(3)科学家用氮化镓组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成了CH4。铜电极表面的电极反应式为__________________________。

(4)已知CO可与I2O5反应:5 CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。将甲醇不完全燃烧产生的500mL(标准状况)气体用足量的I2O5处理后,将所得的I2准确地配成100mL碘的酒精溶液。再取25.00mL该溶液加入淀粉溶液作指示剂后用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL(气体样品中其它成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)。
5CO2(g)+I2(s)。将甲醇不完全燃烧产生的500mL(标准状况)气体用足量的I2O5处理后,将所得的I2准确地配成100mL碘的酒精溶液。再取25.00mL该溶液加入淀粉溶液作指示剂后用0.0100mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL(气体样品中其它成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)。
①滴定终点时溶液颜色变化为____________________________。
②气体样品中CO的体积分数为________________。
【答案】 CH3OH(l)+ 3/2O2(g)= CO2(g)+H2O(l)ΔH=-726.5 kJ·mol-1 < < 0.04mol·L-1·min-1 0.04 CO2+8e-+8H+=CH4+2H2O 蓝色褪为无色 8.96%
【解析】试题分析:本题考查盖斯定律的应用,图像分析,化学反应速率和化学平衡常数的计算,电极反应式的书写,氧化还原反应的滴定实验。
(1)应用盖斯定律,将②+④![]() -①得,CH3OH(l)+
-①得,CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)ΔH=(-571.6kJ/mol)+
O2(g)=CO2(g)+2H2O(l)ΔH=(-571.6kJ/mol)+![]() (-566.0kJ/mol)-(-128.1kJ/mol)=-726.5kJ/mol,CH3OH燃烧热的热化学方程式为CH3OH(l)+
(-566.0kJ/mol)-(-128.1kJ/mol)=-726.5kJ/mol,CH3OH燃烧热的热化学方程式为CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ/mol。
O2(g)=CO2(g)+2H2O(l)ΔH=-726.5kJ/mol。
(2)①根据图示,T2时达到平衡所需时间小于T1时,其他条件相同时升高温度反应速率加快,则T1![]() T2。T2平衡时体系中H2O(g)的体积百分含量小于T1时,升高温度平衡向正反应方向移动,正反应为吸热反应,则对应的平衡常数K1
T2。T2平衡时体系中H2O(g)的体积百分含量小于T1时,升高温度平衡向正反应方向移动,正反应为吸热反应,则对应的平衡常数K1![]() K2。
K2。
②根据图像,温度T2下,2min时体系中H2O(g)的体积百分含量为32%,设从开始到2min时转化H2O(g)物质的量浓度为x,用三段式
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
c(起始)(mol/L) 0.1 0.24 0 0
c(转化)(mol/L) x x x 3x
c(2min末)(mol/L)0.1-x 0.24-x x 3x
![]() =32%,解得x=0.08mol/L,从反应开始到2min时υ(H2O)=
=32%,解得x=0.08mol/L,从反应开始到2min时υ(H2O)=![]() =0.04mol/(L·min)。
=0.04mol/(L·min)。
③T1温度时,设从开始到平衡转化CH4物质的量浓度为y,用三段式
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
c(起始)(mol/L) 0.1 0.24 0 0
c(转化)(mol/L) y y y 3y
c(平衡)(mol/L) 0.1-y 0.24-y y 3y
平衡时H2O(g)的体积百分含量为40%,则![]() =40%,解得y=0.058mol/L,平衡时CH4、H2O(g)、CO、H2物质的量浓度依次为0.042mol/L、0.182mol/L、0.058mol/L、0.174mol/L,该温度下反应的平衡常数K=
=40%,解得y=0.058mol/L,平衡时CH4、H2O(g)、CO、H2物质的量浓度依次为0.042mol/L、0.182mol/L、0.058mol/L、0.174mol/L,该温度下反应的平衡常数K=![]() =
=![]() =0.04。
=0.04。
(3)根据图示在Cu电极表面CO2得到电子被还原成CH4,1molCO2得到8mol电子被还原成1molCH4,Cu电极表面的电极反应式为CO2+8e-+8H+=CH4+2H2O。
(4)①碘的酒精溶液中加入淀粉溶液,溶液变蓝,用Na2S2O3滴定到终点,I2被完全消耗,滴定终时溶液颜色的变化为:蓝色褪为无色。
②根据方程式5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)和2Na2S2O3+I2=2NaI+Na2S4O6,写出关系式5CO~I2~2Na2S2O3,500mL气体样品中含CO物质的量为
5CO2(g)+I2(s)和2Na2S2O3+I2=2NaI+Na2S4O6,写出关系式5CO~I2~2Na2S2O3,500mL气体样品中含CO物质的量为![]() 0.0100mol/L
0.0100mol/L![]() 0.02L
0.02L![]() =0.002mol,标准状况下V(CO)=0.002mol
=0.002mol,标准状况下V(CO)=0.002mol![]() 22.4L/mol=0.0448L=44.8mL,气体样品中CO的体积分数为
22.4L/mol=0.0448L=44.8mL,气体样品中CO的体积分数为![]() 100%=8.96%。
100%=8.96%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于N2的叙述错误的是( )
A.N2既可作氧化剂又可做还原剂
B.雷雨天,空气中的N2和O2可反应生成NO
C.氮的固定是将N2转化成含氮化合物
D.NO和NO2都可稳定存在于空气中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型冠状病毒(COVID—19)是一种致病性很强的RNA病毒,医用酒精、含氯消毒剂、过氧乙酸都可以用于家庭消毒。按照物质的组成和性质进行分类,新型冠状病毒属于
A.氧化物B.单质C.有机物D.无机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】较活泼金属与硝酸反应,产物复杂。如一定浓度的硝酸与镁反应,可同时得到NO、NO2、N2三种气体。某同学欲用下列仪器组装装置来直接验证有NO、NO2生成并制取氮化镁。(假设实验中每步转化均是完全的)

已知:①NO2沸点是21.1℃、熔点是-11℃;NO的沸点是-151℃、熔点是-164℃;②氮化镁遇水会发生水解。
回答下列问题:
(1)为达到上述实验目的,所选用的仪器的正确连接方式是(_____) (填序号)。
a. A→ D → C → F → B → F →E b. A→ C → D → F → B → F →E
c. A→ F → C → D → F → B →E d. A→ F → D → C → F → B →E
(2)确定还原产物中有NO2的现象是______________________________,实验中两次使用装置F,第二次使用装置F的作用是____________________________________。
(3)实验前需先打开开关K,向装置内通CO2气体,其目的是____________,当_______________时停止通入CO2。
(4)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式____________________________________________________。
(5)在A中反应开始时,某同学马上点燃B处的酒精灯,实验结束后通过测定发现B处的产品纯度不高,原因是______________________________________(用化学方程式回答)。
(6)验证B处有氮化镁生成的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知RO32-的核内有x个中子,R的质量数为A,则m gRO32-含有电子的物质的量为( )
A. m(A+26-x)/(A+48) B. n(A-x-48)/(A+48)
C. (A-x+50)/Am D. m(A-x+2)/A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11.2L H2O所含分子数为0.5NA
B. 1mol·L-1 CaCl2溶液中所含Ca2+离子的数目为NA
C. 通常状况下,23g NO2与N2O4 的混合物所含的氧原子数为NA
D. 1mol氦气所含的核外电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列元素的半径为:
原子 | N | S | O | Si |
半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是( )
A.1.10×10-10mB.0.80×10-10mC.1.20×10-10mD.0.70×10-10m
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com