
【题目】同温同压下,2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 , 则△H1和△H2的关系是( )
A.△H1<△H2
B.△H1>△H2
C.△H1=△H2
D.无法判断
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业常以CO和H2的混合气体为原料一定条件下制备甲醇。
(1)甲醇与乙醇互为________;完全燃烧时,甲醇与同物质的量的汽油(设平均组成为C8H18)消耗O2量之比为________。
(2)工业上还可以通过下列途径获得H2,其中节能效果最好的是________。
A. 高温分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
B. 电解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
C. 甲烷与水反应制取H2:CH4 + H2O![]() 3H2 + CO
3H2 + CO
D. 在光催化剂作用下,利用太阳能分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
(3)在2L的密闭容器中充入1molCO和2molH2,一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g),测得CO和CH3OH(g)浓度变化如下图所示。
CH3OH(g),测得CO和CH3OH(g)浓度变化如下图所示。

① 从反应开始到平衡,氢气的平均反应速率v(H2)=______mol·L-1·min—1。反应前后容器的压强比为________,平衡时氢气的体积分数为_________。
② 能够判断该反应达到平衡的是_______(填选项)。
A.CO、H2和CH3OH三种物质的浓度相等
B.密闭容器中混合气体的密度不再改变
C.CH3OH分解的速率和CH3OH生成的速率相等
D.相同时间内消耗1 mol CO,同时消耗1 mol CH3OH
(4)为使合成甲醇原料的原子利用率达100%,实际生产中制备水煤气时还使用CH4,则生产投料时,n(C)∶n(H2O)∶n(CH4)=__________。
(5)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-。写出该电池负极电极反应式__________________,正极电极反应式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由淀粉发酵最终可制得有机化合物A,某同学为研究A的化学组成,进行如下实验:
(1)称取0.9g有机物A,在一定条件下使其完全气化。已知相同条件下同体积H2为0.02g,则有机物A的相对分子质量为__________。
(2)若将上述有机物A蒸汽在O2中完全燃烧只生成CO2和H2O(g),产物全部被碱石灰吸收,碱石灰增重1.86g;若通入过量石灰水中,产生3.0g沉淀,则A的分子式_______。
(3)另取0.9g的有机物A跟足最金属钠反应,生成H2224mL(标况);若与足最NaHCO3反应,生成224mLCO2(标况)。通过化学分析知A结构中含有一个“-CH3”则A的结构简式是______。
(4)有机物A能与纯铁粉反应可制备一种补铁药物(亚铁盐),该反应的化学方程式为______(有机物用简式表示)。该药物可以治疗的疾病是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质结构决定性质,新材料的不断涌现有力地促进了社会进步,因此了解物质结构具有重要意义。试回答下列问题:
(1)基态铁原子中未成对电子数为_________,在水溶液中常以Fe2+、Fe3+的形式存在,其中________更稳定。
(2)OF2中氧元素的化合价为____,中心原子的杂化方式为___,OF2的分子极性比H2O的__________(选填“大”或“小”)。
(3)一种新型铝离子电池中的电解质溶液由某种有机阳离子与AlCl4﹣、Al2Cl7﹣构成,AlCl4﹣的立体构型为_________,Al2Cl7﹣中的原子都是8电子结构,则Al2Cl7﹣的结构式为(配位键用“→”表示)__________。
(4)FeO晶体与NaCl晶体结构相似,要比较FeO与NaCl的晶格能大小,还需要知道的数据是___________;
(5)氮化铝、氮化硼、氮化镓晶体的结构与金刚石相似,它们晶体的熔点由高到低的顺序是___________。
(6)NH3分子中∠HNH键角为106.7,而配离子[Zn(NH3)6]2+中∠HNH键角为109.5, 配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_____。
(7)下图是Fe3O4晶体的晶胞。

①晶胞中亚铁离子处于氧离子围成的______(选填“正方形”、“正四面体”或“正八面体”)空隙。
②晶胞中氧离子的堆积方式的名称为________。
③若晶胞的体对角线长为 a nm,则 Fe3O4 晶体的密度为________g/cm3(阿伏加德罗常数用 NA 表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
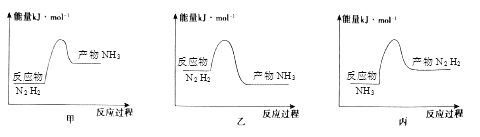
【题目】工业上合成氨反应为:N2+3H2![]() 2NH3,回答下列问题:
2NH3,回答下列问题:
(1)反应过程中拆开的化学键是_______;
(2)反应放热,从价键角度分析,反应放热的原因是_______,下列图像正确的是_______。
(3)在体积是2L的密闭容器中开始加入1molN2,3molH2,反应过程浓度中,物质的浓度与时间的关系如图所示。

①t1时生成NH3的物质的量是_______;用H2表示的化学反应速率υ(H2)=_______。
②下列各项能表明反应达到化学平衡状态的是_______。
A.容器中气体的密度保持不变
B.容器中气体的压强不变
C.氨气的含量不变
D.拆开3molH—H键同时形成6molN—H键
(4)下列措施中能提高合成氨反应化学反应速率的是_______。
A.使用高效催化剂 B.恒温恒容再充入氢气 C.降低反应温度 D.扩大容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学物质结构知识,请你回答下列问题:
(1)人们把电子云轮廓图称为原子轨道,s电子的原子轨道都是形的,p电子的原子轨道都是形的.
(2)原子序数为24的元素原子中有个能层,个能级,未成对电子.
(3)具有(n﹣1)d10ns2电子构型的元素位于周期表中区和族.
(4)H2O、BF3、PCl3和PCl5四种分子中各原子均达8电子结构的分子是
(5)NCl3常温下为黄色粘稠的油状液体,可用作引爆剂和化学试剂.NCl3分子的立体构型是 , 中心原子采取杂化方式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为周期表的一部分,表中所列的字母分别代表一种化学元素.
回答下列相关问题:
(1)写出元素f简单离子的结构示意图 .
(2)在c6a6分子中,元素c为杂化,该分子是分子(填“极性”或“非极性”).
(3)ci2分子的电子式为 , ci2与ce2比较,沸点较高的是(写分子式).
(4)第一电离能:hi;电负性:gb(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. 2Na2O2+2H2O→4NaOH+O2↑ B. CaH2 +2H2O→Ca(OH) 2 +2H2↑
C. Mg3N2 +6H2O→3Mg(OH)2 ↓+2NH3↑ D. NH4Cl+NaOH![]() NaCl+NH3↑ +H2O
NaCl+NH3↑ +H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com