

(1)在图甲中,试管M中的液体应选用________________.
(2)在图乙中所示的虚线框中应连入的最合适的装置是下图中的________(填代号).

(3)上述制H2的方法与将锌粒直接加入试管中相比其优点有____________________.
(4)实验过程中,在试管M中可观察到的现象是__________________.
(5)用上面的装置也可以做氨气还原氧化铜的实验,其产物对空气无污染,对应的化学反应方程式为______________.在这个实验中试管M中的液体应选用______________.小匙上的固体应选用______________.
(6)某同学把反应装置改成图,容器内加有某液体X,稍加热,铜丝的操作方法同图中乙图,若发现铜丝由黑变红,则液体可能是____________.

| (1)稀H2SO4
(2)B、E (3)控制反应的进行 (4)当铜质燃烧匙插入溶液中时,产生大量气泡,当从溶液中取出燃烧匙时,反应马上停止. (5)2NH3+3CuO  
练习册系列答案
 教材全解字词句篇系列答案 教材全解字词句篇系列答案
相关习题
科目:高中化学 来源: 题型:阅读理解 (1)AgNO3的水溶液呈 酸 酸 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):Ag++H2O  AgOH+H+ AgOH+H+Ag++H2O ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的 AgOH+H+ AgOH+H+硝酸 硝酸 中,然后再用蒸馏水稀释到所需的浓度.若用惰性电极电解AgNO3的水溶液,请写出电池反应的离子方程式4Ag++2H2O
4Ag++2H2O ,
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32-水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 向红色溶液中加入足量BaCl2溶液 向红色溶液中加入足量BaCl2溶液 如果溶液还显红色说明甲正确,红色褪去说明乙正确 如果溶液还显红色说明甲正确,红色褪去说明乙正确 (3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化  如右图所示.则图中表示醋酸溶液中pH变化曲线的是 B B (填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1< < m2(选填“<”、“=”、“>”) (4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一. ①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:负极: 2Fe=2Fe2++4e- 2Fe=2Fe2++4e- 正极:O2+2H2O+4e-=4OH- O2+2H2O+4e-=4OH- ;②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸  门上的固体材料R可以采用 门上的固体材料R可以采用C C .A.铜 B.钠 C.锌 D.石墨 ③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的 负 负 极.(5)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: ①氢氧燃料电池的能量转化主要形式是 化学能转变为电能 化学能转变为电能 ,在导线中电子流动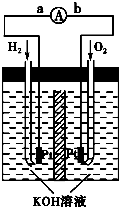 方向为 方向为a→b a→b (用a、b表示).②负极反应式为 2H2+4OH-=4H2O+4e- 2H2+4OH-=4H2O+4e- .③电极表面镀铂粉的原因为 增大电极单位面积吸附H2、O2分子数,加快电极反应速率 增大电极单位面积吸附H2、O2分子数,加快电极反应速率 .查看答案和解析>> 科目:高中化学 来源: 题型:阅读理解 Ⅰ海水中蕴藏着丰富的资源.海水综合利用的流程图如下. 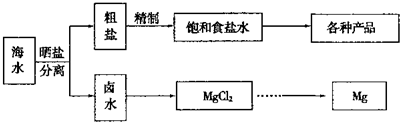  用NaCl做原料可以得到多种产品. ①工业上由NaCl制备金属钠的化学方程式是 2NaCl
2NaCl .
②实验室用惰性电极电解500mL0.1mol/LNaCl溶液,若阴阳两极共得到112mL气体(标准状况),则所得溶液的pH为 12 12 (忽略反应前后溶液的体积变化)③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的总化学方程式: NaCl+H2O
NaCl+H2O .
Ⅱ铝粉是铝热剂的主要成份之一,常用铝锭制得的铝粉中含有少量的Al2O3和SiO2,用如图所示的装置(甲、乙管用橡皮管连接可上下移动)测定铝粉中金属铝的含量,其方法是:用稀硫酸或氢氧化钠溶液与样品作用,通过产生的气体体积计算样品中金属铝的含量,根据实验原理回答下列问题: 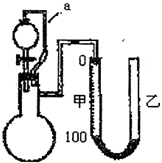 (1)装置中导管a所起的作用是 平衡气压,使分液漏斗中的液体顺利滴下 平衡气压,使分液漏斗中的液体顺利滴下 .(2)为了较准确测量产生的气体体积,在反应前后读取甲管液面的读数时应注意 AD AD .A.反应前后读取甲管液面数据时应使甲、乙中液面保持水平 B.反应后读取甲管液面数据时,甲、乙两管液面无须保持水平 C.反应后立即读取甲管液面数据,防止液面变动 D.反应后静置一会,需待反应器恢复原来温度 (3)若从稀硫酸和氢氧化钠溶液中挑选一种试剂,你选择的试剂是 NaOH溶液 NaOH溶液 ,不选择另一种试剂的理由是由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差 由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差 .查看答案和解析>> 科目:高中化学 来源: 题型:阅读理解 随着环保意识的增强,清洁能源越来越受人们关注. (1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源. ①硫-碘循环分解水制氢主要涉及下列反应: I.SO2+2H2O+I2=H2SO4+2HIⅡ.2HI
分析上述反应,下列判断正确的是 c c (填序号,下同).a.反应Ⅲ易在常温下进行 b.反应I中SO2氧化性比HI强 c.循环过程中需补充H2O d.循环过程中产生l mol O2的同时产生1mol H2 ②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正 > > v逆.(填“>”、“<”或“=”)③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 向右 向右 移动(填“向左”、“向右”或“不”);若加入少量下列固体试剂中的b b ,产生H2的速率将增大.a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3 (2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)
①下列各项中,不能说明该反应已达到平衡的是 d d .a.恒温、恒容条件下,容器内的压强不发生变化 b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等 c.一定条件下,CO、H2和CH3OH的浓度保持不变 d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH ②如图甲是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1 > > K2.(填“>”、“<”或“=”)③已知甲醇燃料电池的工作原理如图乙所示. 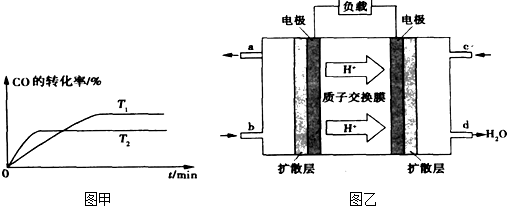 ①该电池工作时,b口通入的物质为 CH3OH CH3OH ,该电池正极的电极反应式为:O2+4e-+4H+=2H2O O2+4e-+4H+=2H2O ,工作一段时间后,当6.4g甲醇(CH3OH)完全反应生成CO2时,有1.2 1.2 mol电子发生转移.查看答案和解析>> 科目:高中化学 来源: 题型:阅读理解 甲醇是基础有机化工原料和新型清洁燃料,广泛用于制造各种燃料电池.工业上以甲烷和水蒸气为原料制备甲醇,反应过程如下. 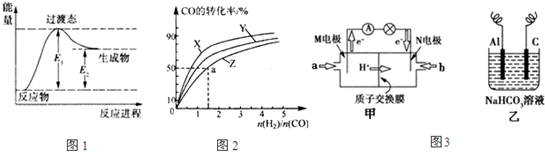 反应Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1 反应Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H2 (△H2<0= (1)图1是反应Ⅰ进行过程中的能量变化示意图.根据图象判断,升高温度,反应I的平衡常数将 (2)已知在催化剂和一定压强下,反应Ⅱ能自发进行.在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律. 图2是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是 (3)图3甲是一种甲醇燃料电池的结构示意图,甲醇提供质子和电子,电子经外电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2
①M电极的电极反应式为 ②以上述电池做电源,用图3乙所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现Al电极附近逐渐变浑浊并有气泡逸出,原因是(用离子方程式表示): (4)合成甲醇时可选用CuCl为催化剂.CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu═2CuCl.在实验过程中应先加入浓盐酸,发生反应CuCl+HCl?H[CuCl2].反应结束后将溶液倒入蒸馏水中有CuCl生成.实验过程中加入浓盐酸的目的是 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |