
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。
Ⅰ.工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为 。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
① 已知:OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-484 kJ·mol-1 K2
2H2O(g) ΔH=-484 kJ·mol-1 K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)![]() OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。

② 当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是 、
Ⅱ.乙二醛电解氧化制备乙醛酸(OHC—COOH)的生产装置如下图所示,通电后,阳极产生的Cl2 与乙二醛溶液反应生成乙醛酸。

(3)阴极电极式为
(4)阳极液中盐酸的作用,除了产生氯气外,还有
(5)保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η=
(设:法拉第常数为f C·mol-1;η=![]() )
)
【答案】
(1)3CH3CHO+4HNO3![]() 3OHC-CHO+4NO↑+5H2O;尾气中NO有污染(或“腐蚀设备”等其他合理答案)
3OHC-CHO+4NO↑+5H2O;尾气中NO有污染(或“腐蚀设备”等其他合理答案)
(2)① -406; ![]()
② 反应温度在450~495℃之间时,温度升高,主反应平衡向逆反应方向移动;温度大于495℃时,乙二醇大量转化为CO2等副产物
(3)2H++2e-===H2↑
(4)增强导电性(或“平衡阴极区电解液电荷”等其他合理答案)
(5)![]() %
%
【解析】
试题分析:(1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO,反应方程式为:3CH3CHO+4HNO3![]() 3OHC-CHO+4NO↑+5H2O,存在比较明显的缺点是:生成的NO会污染空气,硝酸会腐蚀设备,故答案为:3CH3CHO+4HNO3
3OHC-CHO+4NO↑+5H2O,存在比较明显的缺点是:生成的NO会污染空气,硝酸会腐蚀设备,故答案为:3CH3CHO+4HNO3![]() 3OHC-CHO+4NO↑+5H2O;生成的NO会污染空气,硝酸会腐蚀设备;
3OHC-CHO+4NO↑+5H2O;生成的NO会污染空气,硝酸会腐蚀设备;
(2)①已知:Ⅰ.OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g)△H=-78kJmol-1 K1 ,Ⅱ.2H2(g)+O2(g)
HOCH2CH2OH(g)△H=-78kJmol-1 K1 ,Ⅱ.2H2(g)+O2(g)![]() 2H2O(g)△H=-484kJmol-1 K2,根据盖斯定律,Ⅱ-Ⅰ可得:HOCH2CH2OH(g)+O2(g)
2H2O(g)△H=-484kJmol-1 K2,根据盖斯定律,Ⅱ-Ⅰ可得:HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g),则△H=-484kJmol-1-(-78kJmol-1)=-406kJmol-1,平衡常数K反应Ⅱ与Ⅰ的平衡常数的商,即K=
OHC-CHO(g)+2H2O(g),则△H=-484kJmol-1-(-78kJmol-1)=-406kJmol-1,平衡常数K反应Ⅱ与Ⅰ的平衡常数的商,即K=![]() ,故答案为:-406;
,故答案为:-406;![]() ;
;
②主反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物,使乙二醛产率降低,故答案为:反应温度在450~495℃之间时,温度升高,主反应平衡向逆反应方向移动;温度大于495℃时,乙二醇大量转化为CO2等副产物;
OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物,使乙二醛产率降低,故答案为:反应温度在450~495℃之间时,温度升高,主反应平衡向逆反应方向移动;温度大于495℃时,乙二醇大量转化为CO2等副产物;
(3)阴极是氢离子放电生成氢气,电极反应式为:2H++2e-=H2↑,故答案为:2H++e-=H2↑;
(4)阳极液中盐酸可以增强溶液导电性,故答案为:增强溶液导电性;
(5)电极通过总电量为60t s×a A=60ta C,则电极上通过电子总物质的量=![]() mol;生成乙醛酸的物质的量为
mol;生成乙醛酸的物质的量为![]() =
=![]() mol,醛基转化为羧基,C原子化合价升高2价,消耗电子物质的量2×
mol,醛基转化为羧基,C原子化合价升高2价,消耗电子物质的量2×![]() mol,故电解中的电流效率η=
mol,故电解中的电流效率η= ×100%=
×100%=![]() %,故答案为:
%,故答案为:![]() %
%


科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )

A.N4分子属于一种新型的化合物 B.N4分子中只含有非极性键
C.1molN4分子所含共价键数为4NA D.N4沸点比P4(白磷)高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+=H2O+S↓+SO2↑)

(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是_______________;除如图装置所示的实验用品、仪器外,还需要的意见实验仪器是__________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是________________________。
(3)试简述测定该反应的化学反应速率的其他方法:__________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
实验 序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是_____________淀粉溶液的作用是____________。
(5)表中Vx=_______mL,比较t1、t2、t3大小,试推测该实验结论: ____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因是 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断
提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:w.w.w..c.o.mⅠ.2Li+H2![]() 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。
(已知:Ksp(MnCO3)=2.2×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38)
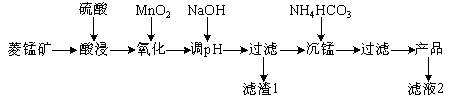
(1)滤渣1中,含铁元素的物质主要是 (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中 含量减少。
(2)滤液2中,+1价阳离子除了H+外还有 (填离子符号)。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
①Mn2+与(NH4)2S2O8反应的还原产物为 (填化学式)。
②“沉锰”前溶液中c(Mn2+)= mol·L-1。
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。

①NH4HCO3初始浓度越大,锰元素回收率越 (填“高”或“低”),简述原因 。
②若溶液中c(Mn2+)=1.0 mol·L-1,加入等体积1.8 mol·L-1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):_____。
(2)倒入NaOH溶液的正确操作是________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)若用50mL0.55mol/LHCl与50 mL 0.55 mol/L NaOH溶液反应测定中和热,则测出的中和热,
(填偏大 偏小 不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如图所示。

(1)下列关于M的说法正确的是______(填序号)。
a.属于芳香族化合物 b.遇FeCl3溶液显紫色
c.能使酸性高锰酸钾溶液褪色 d.1molM完全水解生成2mol醇
(2)肉桂酸是合成M的中间体,其一种合成路线如下:

①烃A的名称为______。步骤I中B的产率往往偏低,其原因是__________。
②步骤II反应的化学方程式为______________。
③步骤III的反应类型是________。
④肉桂酸的结构简式为__________________。
⑤C的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式_________________。
(2)298 K时,在2L恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g)ΔH=-a kJ·mol-1 (a>0)。N2O4的物质的量浓度随时间变化如图1。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g)ΔH=-a kJ·mol-1 (a>0)。N2O4的物质的量浓度随时间变化如图1。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。

①298k时,该反应的平衡常数为________。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示。
下列说法正确的是( )
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图3所示。试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是__________(填“a”“b”“c”“d”或“e”,下同)
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M(![]() )是一种重要的化工原料,请回答下列问题:
)是一种重要的化工原料,请回答下列问题:
(1)M的分子式为 。
(2)M与H2按物质的量比1:1反应的产物,可能具有的性质是 (填序号)
A.易燃 B.难溶于水 C.可发生加成反应
(3)某耐热型树脂R可由M和丙烯腈(CH2=CHCN)共聚而成。假定按1:1比例反应,试写出R的结构简式: 。
(4)以M为原料合成产品N(![]() )的流程如下(条件略)
)的流程如下(条件略)

则A的结构简式为 ,反应②的发生条件通常是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com