
下列各项表达中,正确的是
A.水的电子式为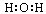 |
| B.将58g等体积的乙烯和乙烷混合物完全燃烧,生成的二氧化碳体积为89.6L |
| C.所有的氮原子中,质子数都是7个,但不一定是相同的原子 |
D.氯离子的结构示意图为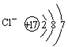 |
C
解析试题分析:水是含有共价键的共价化合物,电子式是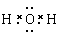 ,A不正确;乙烷和乙烯的相对分子质量不同,分别是30和28,在体积相等的条件下,58g混合气中二者的物质的量分别都是1mol,完全燃烧生成的CO2是4mol,但气体的状态不一定是在标准状况下,无法计算气体的体积,选项B不正确;氮元素有同位素,因此所有的氮原子中,质子数都是7个,但不一定是相同的原子,选项C正确;氯离子的最外层电子数是8个,选项D不正确,答案选C。
,A不正确;乙烷和乙烯的相对分子质量不同,分别是30和28,在体积相等的条件下,58g混合气中二者的物质的量分别都是1mol,完全燃烧生成的CO2是4mol,但气体的状态不一定是在标准状况下,无法计算气体的体积,选项B不正确;氮元素有同位素,因此所有的氮原子中,质子数都是7个,但不一定是相同的原子,选项C正确;氯离子的最外层电子数是8个,选项D不正确,答案选C。
考点:考查常见化学用语的正误判断、物质的量的计算
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。


科目:高中化学 来源: 题型:单选题
NA为阿伏加德罗常数的数值,下列叙述正确的是
| A.22.4L NH3中含氮原子数为NA |
| B.1 mol Na2O2与水完全反应时转移的电子数为NA |
| C.1 L 0.1mol·L-1碳酸钠溶液的阴离子总数等于0.1 NA |
| D.1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A.足量Fe与1 mol Cl2燃烧反应时,转移的电子数为3 NA |
| B.1 mol NO2与足量H2O反应,转移的电子数为NA |
| C.常温常压下,9.2g的NO2和N2O4混合气体中含有的氮原子数为0.2 NA |
| D.高温、催化剂作用,0.4 mol SO2与足量氧气反应生成的SO3分子数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关碳元素及其化合物的化学用语正确的是
A.CO2的电子式: |
B.乙烯的比例模型: |
| C.醋酸钠的分子式:C2H3O2Na |
D.C原子最外层电子的轨道表示式: |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①3.2 g O2和O3的混合气中含有的氧原子数目为0.2 NA
②含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
④标准状况下,22.4LC6H6(苯)的分子数目为NA
⑤1 L 0.1 mol/L的 Al2(SO4)3溶液中,Al3+的数目为0.2 NA
| A.①②③④⑤ | B.①③④⑤ | C.②③④⑤ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A气体极易溶于水,其相对分子质量为a,在0℃、1.01×105Pa时,测得其饱和溶液的物质的量浓度为b mol/L,该溶液的密度为c g/cm3,求:
(1)A饱和溶液中溶质的质量分数;
答:c%=
(2)0℃、1.01×105帕时,1体积水中可溶解多少体积的A气体?
答:V=
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答: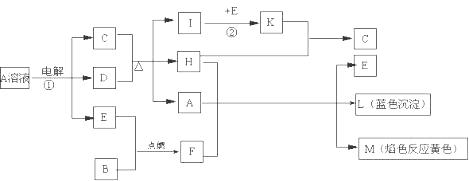
⑴L的化学式: F的电子式: 。
⑵反应①的离子方程式: 。
⑶反应②,工业上采取的反应条件: 。
⑷每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示: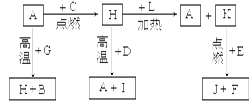
请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;该反应的化学方程式为 ___________________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式_________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
制备Cl2需用8mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
(1)需要用量筒量取12 mol·L-1的盐酸的体积为 mL;
(2)实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号) 。
A.100mL量筒 B.托盘天平
C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
G.100mL烧杯 H.100mL容量瓶
(3)下列实验操作中,不正确的是 (填写标号)。
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2 cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com