
【题目】CO2 分子中σ键与π键数目比为( )
A.2:1
B.1:2
C.1:1
D.1:3
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】已知(CH3COOH)2(g)2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量随温度(T)的变化曲线如图所示,下列说法正确的是( ) 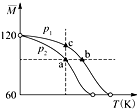
A.该过程的△H<0
B.气体压强:p(a)<p(b)=p(c)
C.平衡常数:K(a)=K(b)<K(c)
D.测定乙酸的相对分子质量要在高压、低温条件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CaSO4代替O2与燃料CO反应是一种高效、清洁的新型燃烧技术.反应如下:
① ![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g) ![]() CaS(s)+CO2(g)△H1=﹣47.3 kJmol﹣1
CaS(s)+CO2(g)△H1=﹣47.3 kJmol﹣1
②CaSO4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJmol﹣1
③CO(g) ![]() C(s)+
C(s)+ ![]() CO2(g)△H3=﹣86.2kJmol﹣1 .
CO2(g)△H3=﹣86.2kJmol﹣1 .
下列说法错误的是( )
A.反应①达到平衡时,增大压强平衡不移动
B.反应②的平衡常数表达式为K= ![]()
C.反应①和②是主反应,反应③是副反应
D.2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应A(g)+B(g)C(g)△H<0达到平衡后,据下列图象判断:
达到新的平衡对应的图象 | 平衡移动方向 | |
(i)使用催化剂 | ||
(ii)升温 | ||
(iii)降压 | ||
(iv)增加A的量 | ||
(v)减少C的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)配制0.50mol/L NaOH溶液
(i)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体g.
(ii)从图中选择称量NaOH固体所需要的仪器是(填字母):
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示. 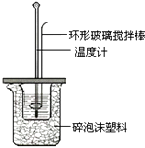
(i)写出该反应的热化学方程式(中和热为57.3kJ/mol): .
(ii)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4/p> | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃、101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
O2(g)=8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
B.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l)△H=﹣5518 kJmol﹣1
O2(g)=8CO2(g)+9H2O(l)△H=﹣5518 kJmol﹣1
C.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l)△H=+5518 kJmol﹣1
O2(g)=8CO2(g)+9H2O(l)△H=+5518 kJmol﹣1
D.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l)△H=﹣48.40 kJmol﹣1
O2(g)=8CO2(g)+9H2O(l)△H=﹣48.40 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2 , 转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2 , 转移的电子数目为3.75NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有碳酸钠和碳酸氢钠的固体混合物,先取m g固体样品进行加热,完全分解产生CO2气体112 mL;另取m g固体样品溶于水,加入足量的盐酸时产生CO2 448 mL(气体体积均为标准状况下测定)。
(1)求m g混合物中碳酸氢钠与碳酸钠的物质的量各是多少?_________
(2)若产生448 mL CO2时,消耗盐酸的体积为300mL,则该盐酸的物质的量浓度是多少?____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com