
【题目】化学能与热能、电能等可以相互转化.关于化学能与其他能量相互转化的说法正确的是( )
A. 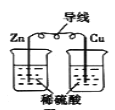 将化学能转变为电能
将化学能转变为电能
B. 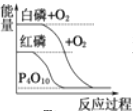 白磷比红磷稳定
白磷比红磷稳定
C.  发生的反应为放热反应
发生的反应为放热反应
D.  明在其他条件相同时,按途径Ⅰ发生反应与按途径Ⅱ发生反应,并产生相等质量氧气时放出的热量不相等
明在其他条件相同时,按途径Ⅰ发生反应与按途径Ⅱ发生反应,并产生相等质量氧气时放出的热量不相等
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体的制备方法:________________________化学方程式为_____________________。FeCl3净水的原理__________(离子方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
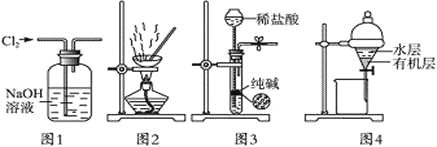
A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式对应正确的是( )
A.铜绿﹣CuSO45H2O
B.明矾一KAl(SO4)212H2O
C.苏打一 NaHCO3
D.铁红一Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 放热反应不需加热即可发生
B. 化学反应过程中的能量变化除了热能外,也可以是光能、电能等
C. 需要加热才能进行的化学反应不一定是吸热反应
D. 化学反应热效应数值与参加反应的物质多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA
B. 标准状况下,由H2O2制得4.48LO2转移的电子数目为0.8NA
C. 14g由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA
D. 25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新型储氢材料是氢能源利用的重要研究方向之一。请回答以下问题:
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的电子排布式为____________________;LiBH4中Li、B、H元素的电负性由大到小的排列顺序为_________________。
②另有一种含钛元素的新型材料,其理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型为____________。

(2)氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
①NH3BH3中是否存在配位键__________(填“是”或“否”);与NH3BH3互为等电子体的分子的化学式为__________。
②B、C、N与O元素的第一电离能由大到小的顺序为___________________。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则立方氮化硼晶体可用作___________(选填下列字母序号)。
a.切削工具 b.钻探钻头 c.导电材料 d.耐磨材料
(3)一种有储氢功能的铜合金晶体具有面心立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。
①若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为________________;
②铜与其它许多金属及其化合物都可以发生焰色反应,其原因是_______________。
(4)金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素R的氢化物。R的部分电离能如下表所示:
I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
①该金属元素是___________(填元素符号)..
②若氢化物的晶胞结构如图所示(有4个H原子位于面上,其余H原子位于晶胞内),已知该晶体的密度为ρg·cm-3,则该晶胞的体积为__________cm3[用含ρ、NA的代数式表示(其中NA为阿伏加德罗常数的值)]。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,可生成一种淡黄色的固体F,E的L层电子数等于K、M层电子数之和。
(1)E在元素周期表中的位置__________,B常见氢化物的电子式为_______;F的电子式为________。
(2)B、C、D、E元素的简单离子半径由大到小的顺序为__________________ (用离子符号表示,下同)。A、B、C元素气态氢化物的稳定性由强到弱的顺序为_______________。
(3)已知A、E两种元素形成的化合物X,X结构与干冰相似,属于_________ (填“离子”或“共价”)化合物。
(4)用电子式表示D与E化合形成D2E的过程:_____________________。
(5)C和E分别能与氢形成18个电子的化合物,这两种化合物发生反应,可生成E单质,其反应的化学方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com