
【题目】A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,可生成一种淡黄色的固体F,E的L层电子数等于K、M层电子数之和。
(1)E在元素周期表中的位置__________,B常见氢化物的电子式为_______;F的电子式为________。
(2)B、C、D、E元素的简单离子半径由大到小的顺序为__________________ (用离子符号表示,下同)。A、B、C元素气态氢化物的稳定性由强到弱的顺序为_______________。
(3)已知A、E两种元素形成的化合物X,X结构与干冰相似,属于_________ (填“离子”或“共价”)化合物。
(4)用电子式表示D与E化合形成D2E的过程:_____________________。
(5)C和E分别能与氢形成18个电子的化合物,这两种化合物发生反应,可生成E单质,其反应的化学方程式为_____________。
【答案】第三周期第ⅥA族 ![]()
![]() r(S2-)>r(N3-)>r(O2-)>r(Na+) H2O>NH3>CH4 共价
r(S2-)>r(N3-)>r(O2-)>r(Na+) H2O>NH3>CH4 共价 ![]() H2O2+H2S =S↓ +2H2O
H2O2+H2S =S↓ +2H2O
【解析】
A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子,为第IVA族元素;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,生成一种淡黄色的固体F,则C是O元素、D是Na元素,F为Na2O2;A原子序数小于C,则A是C元素,B原子序数大于A而小于C,则B是N元素;E的L层电子数等于K、M层电子数之和,则M层为6个电子,为S元素,再结合元素周期表结构、物质结构及性质分析解答。
根据上述分析可知,
(1)E为S元素,在元素周期表中的位置为:第三周期第ⅥA族;B为N元素,常见氢化物为氨气,其电子式为:![]() ;F为过氧化钠,含有离子键与非极性键,其电子式为
;F为过氧化钠,含有离子键与非极性键,其电子式为![]() ,
,
故答案为:第三周期第ⅥA族;![]() ;
;![]() ;
;
(2)电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以B、C、D、E元素的简单离子半径由小到大的顺序为S2- > N3- > O2- >Na+;同周期元素中,从左到右非金属性依次增强,又元素非金属性越强,其气态氢化物的稳定性越好,所以A、B、C元素气态氢化物的稳定性由强到弱的顺序为H2O>NH3>CH4,
故答案为:S2- > N3- > O2- >Na+;H2O>NH3>CH4;
(3)干冰为二氧化碳的固体形态,A、E两种元素形成的化合物X为CS2,其结构与干冰相似,则该化合物属于共价化合物,
故答案为:共价;
(4)D是Na元素,E为S元素,两者结合形成离子化合物,其用电子式表示硫化钠的形成过程为:![]() ,
,
故答案为:![]() ;
;
(5)C与氢形成可形成过氧化氢18电子化合物,E和氢元素形成硫化氢18电子化合物,两者发生氧化还原反应,生成硫单质与水,其化学方程式为:H2O2+H2S =S↓ +2H2O,
故答案为:H2O2+H2S =S↓ +2H2O。


科目:高中化学 来源: 题型:
【题目】化学能与热能、电能等可以相互转化.关于化学能与其他能量相互转化的说法正确的是( )
A. 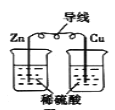 将化学能转变为电能
将化学能转变为电能
B. 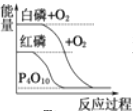 白磷比红磷稳定
白磷比红磷稳定
C.  发生的反应为放热反应
发生的反应为放热反应
D.  明在其他条件相同时,按途径Ⅰ发生反应与按途径Ⅱ发生反应,并产生相等质量氧气时放出的热量不相等
明在其他条件相同时,按途径Ⅰ发生反应与按途径Ⅱ发生反应,并产生相等质量氧气时放出的热量不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验目的与装置或仪器不一致的是 ( )
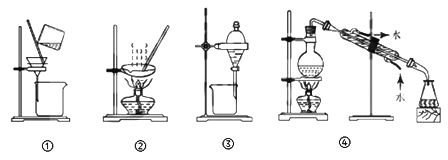
A. 粗盐提纯,选①和② B. 实验室制取蒸馏水,选④
C. 用CC14提取碘水中的碘,选③ D. 分离Na2CO3溶液和CH3COOC2H5,选①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲进行下列实验,其方案设计合理的是( )
A | B | C | D |
检验装置气密性 | 实验室制Fe(OH)2 | 验证浓H2SO4的脱水性、 强氧化性 | 比较NaHCO3和Na2CO3溶解度 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,在容积固定的密闭容器中发生反应H2(g)+I2(g)==2HI(g) △H<0,达到化学平衡状态且其他条件不变时,如果升高温度,平衡混合物的颜色______ (填“变深”、“变浅”或“不变”);向容器中通入一定量的氢气,化学平衡将向________反应方向移动(填“正”或“逆”)。
(2)25。C时,将pH=3的醋酸溶液稀释100倍后,溶液的pH为_________(填序号字母)。
a.5 b.1 C.3—5之间 d.1—3之间
(3)25。C时,向0.1 mol·L-1的Na2C03溶液中加入NaOH固体,固体溶解过程中,不考虑体系温度的变化,CO32-的浓度________(填“增大”、“减小”或“不变”)。
(4)25℃时,用石墨作电极电解1 L 0.1 mol·L-1的NaCl溶液,5 min后,在一个电极上有 1.12 L氢气析出(气体体积已折算为标准状况下数值)。则:
①析出氢气的电极是________极,其电极反应式为 ____________________
②此时,溶液所含溶质为__________ ,溶液的pH= _________(电解前后溶液体积变化及气体的溶解均忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、M、Q、R分别代表某一化学元素。请用所给元素回答下列问题:
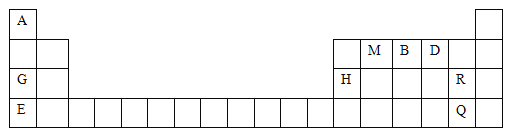
(1)写出下列元素的符号:B______、D________、H________。
(2)M元素的原子结构示意图为__________________。
(3)Q元素在元素周期表中的位置为_____________。Q的单质常温下为_________色液体,氧化性比R的单质氧化性__________(填“强”或“弱”)。
(4)G与E中金属性较强的是_________(填元素符号),其理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应A2(g)+B2(g)![]() xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
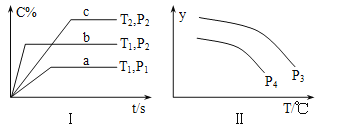
A. P3<P4,y为A2转化率
B. P3<P4,y为A2浓度
C. P3>P4,y为混合气密度
D. P3>P4,y为C的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)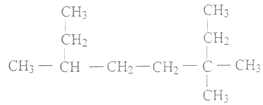 的名称为_____________;
的名称为_____________;
(2) 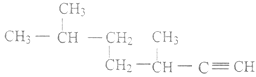 的名称为_________________;
的名称为_________________;
(3)邻甲基乙苯的结构简式为_________________;
(4)顺-2-戊烯的结构简式为_________________;
(5)分子式为C6H12的某烯烃所有碳原子一定共平面,则该烯烃的结构简式为_________________;
(6)某高聚物的结构简式如图:
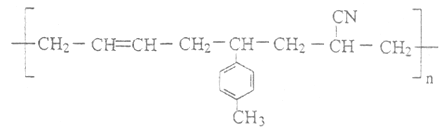
则形成该高分子化合物的单体的结构简式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com