
【题目】元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、M、Q、R分别代表某一化学元素。请用所给元素回答下列问题:
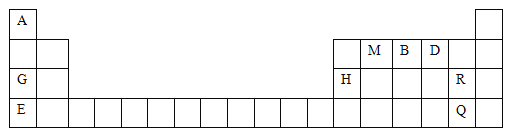
(1)写出下列元素的符号:B______、D________、H________。
(2)M元素的原子结构示意图为__________________。
(3)Q元素在元素周期表中的位置为_____________。Q的单质常温下为_________色液体,氧化性比R的单质氧化性__________(填“强”或“弱”)。
(4)G与E中金属性较强的是_________(填元素符号),其理由是__________________。
【答案】N O Al 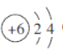 第四周期ⅦA族 深红棕 弱 K K的原子半径大于Na,K比Na更容易失电子
第四周期ⅦA族 深红棕 弱 K K的原子半径大于Na,K比Na更容易失电子
【解析】
根据元素在周期表的位置判断元素,然后根据元素的位置与原子结构的关系可画出原子结构示意图、利用元素及化合物知识判断其单质在通常情况下的存在状态,利用同一主族元素的性质递变规律判断单质的氧化性的强弱及元素金属性强弱的原因,据此分析解答。
(1)根据元素在周期表的位置可确定B是N元素,D是O元素,H是Al元素;
(2)M元素是C元素,原子核外有6个电子,电子排布为2、4,故其原子结构示意图为![]() ;
;
(3)根据元素的位置与原子结构的关系可知R是Cl元素,Q元素是Br元素,在元素周期表中的位置为第四周期ⅦA族;Q的单质常温下为液色液体,由于同一主族的元素从上到下原子半径逐渐增大,获得电子的能力逐渐减弱,所以单质的氧化性逐渐减弱,所以Br2的氧化性比Cl2的单质氧化性弱;
(4)根据元素在周期表的位置可知G是Na元素,E是K元素,由于二者在周期表中位于同一主族,随着原子序数的增大,原子半径K>Na,原子半径越大,元素原子失去电子的能力就越强,元素的金属性就越强,所以金属性较强的是K元素。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA
B. 标准状况下,由H2O2制得4.48LO2转移的电子数目为0.8NA
C. 14g由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA
D. 25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是 ( )
A. 氧化铝与稀盐酸:Al2O3 + 6H+ ![]() 2Al3+ + 3H2O
2Al3+ + 3H2O
B. 氯气与氢氧化钠溶液:Cl2 + 2OH- ![]() Cl-+ ClO- + H2O
Cl-+ ClO- + H2O
C. 碳酸钙与稀盐酸:CO3 2-+ 2H+ ![]() CO2↑+ H2O
CO2↑+ H2O
D. 铜与浓硝酸:Cu + 4H++ 2NO3- ![]() Cu2++ 2NO2↑ + 2H2O
Cu2++ 2NO2↑ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,可生成一种淡黄色的固体F,E的L层电子数等于K、M层电子数之和。
(1)E在元素周期表中的位置__________,B常见氢化物的电子式为_______;F的电子式为________。
(2)B、C、D、E元素的简单离子半径由大到小的顺序为__________________ (用离子符号表示,下同)。A、B、C元素气态氢化物的稳定性由强到弱的顺序为_______________。
(3)已知A、E两种元素形成的化合物X,X结构与干冰相似,属于_________ (填“离子”或“共价”)化合物。
(4)用电子式表示D与E化合形成D2E的过程:_____________________。
(5)C和E分别能与氢形成18个电子的化合物,这两种化合物发生反应,可生成E单质,其反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。
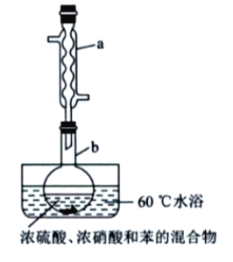
下列说法不正确的是( )
A. 水浴加热的优点为使反应物受热均匀、容易控制温度
B. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加人浓硫酸,待冷却至室温后,将所得混合物加入苯中
C. 实验过程中发现仪器b中未加入碎瓷片,可冷却后补加
D. 反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.Na+、H+、SO42-、HCO3-B.NO3-、OH-、Na+、NH4+
C.Mg2+、Na+、Cl-、OH-D.OH-、Na+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答下列问题:
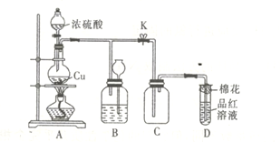
(1)装置A中发生反应的化学方程式为________________________。
(2)装置D中试管口放置的棉花应用一种液体浸泡一下,这种液体是_____,其作用是______。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭弹簧夹K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是___________________。B中应放置的液体是___(填字母)。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现圆底烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_______________________。
②下列药品中能用来证明反应结束后的圆底烧瓶中确有余酸的是_________(填字母)。
a.铁粉 b.BaC12溶液 c.银粉 d.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠跟足量的 NaHCO3混合后,在密闭容器中充分加热,排净气体物质后冷却残留的固体物质是( )
A. Na2CO3 B. NaOH、Na2CO3
C. Na2O2、Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
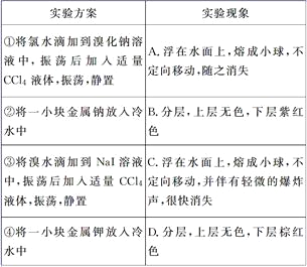
请你帮助该同学整理并完成实验报告。
(1)实验目的:_____________________。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol·L-1溴化钠溶液、0.1 mol·L-1碘化钠溶液、四氯化碳等;
②仪器:________、________、________、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):________

(4)实验结论:__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com