
【题目】按要求回答下列问题:
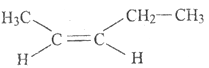
(1)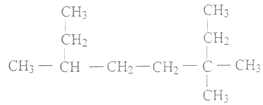 的名称为_____________;
的名称为_____________;
(2) 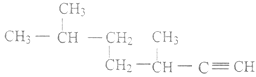 的名称为_________________;
的名称为_________________;
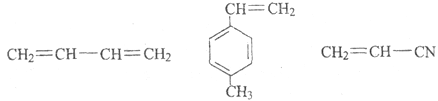
(3)邻甲基乙苯的结构简式为_________________;
(4)顺-2-戊烯的结构简式为_________________;
(5)分子式为C6H12的某烯烃所有碳原子一定共平面,则该烯烃的结构简式为_________________;
(6)某高聚物的结构简式如图:
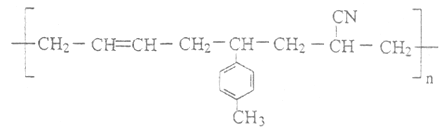
则形成该高分子化合物的单体的结构简式为_________________。
【答案】 3,3,6-三甲基辛烷 3,6-二甲基-1-庚炔 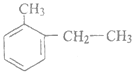
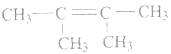
【解析】(1)按照烷烃的命名原则进行命名。
(2)按照炔烃的命名原则进行命名。
(3)甲基、乙基在苯环的邻位上,写出结构简式。
(4)甲基、乙基在碳碳双键的同一侧,为顺式结构。
(5)结合乙烯分子结构,把4个氢分别用4个甲基取代,即可得到该有机物结构简式。
(6)该高聚物的形成过程属于加聚反应,加聚反应是由不饱和单体( 如碳碳双键,碳碳叁键以及碳氧双键等) 聚合形成高分子的反应,其产物只有一种高分子化合物;凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换,按照上述规律写出单体的结构简式。
(1) 该有机物为烷烃,主碳链为8个碳,甲基分别位于3,3,6位的碳上,名称为3,3,6-三甲基辛烷;正确答案:3,3,6-三甲基辛烷。
该有机物为烷烃,主碳链为8个碳,甲基分别位于3,3,6位的碳上,名称为3,3,6-三甲基辛烷;正确答案:3,3,6-三甲基辛烷。
(2) 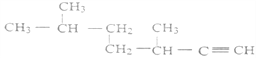 该有机物物为炔烃,含有碳碳三键在内的主碳链为7个碳,甲基位于3,6位的碳上,名称为3,6-二甲基-1-庚炔;正确答案:3,6-二甲基-1-庚炔。
该有机物物为炔烃,含有碳碳三键在内的主碳链为7个碳,甲基位于3,6位的碳上,名称为3,6-二甲基-1-庚炔;正确答案:3,6-二甲基-1-庚炔。
(3)甲基、乙基在苯环的邻位,邻甲基乙苯的结构简式为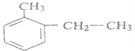 ;正确答案:
;正确答案: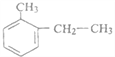 。
。
(4)甲基、乙基在同侧,顺-2-戊烯的结构简式为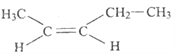 ;正确答案:
;正确答案:![]() 。
。
(5)乙烯分子为平面结构,6个原子共平面,把4个氢分别用4个甲基取代,即可得到分子式为C6H12的所有碳原子一定共平面的烯烃,结构简式为: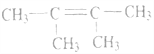 ;正确答案:
;正确答案: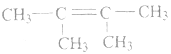 。
。
(6)该高聚物的形成过程属于加聚反应,加聚反应是由不饱和单体( 如碳碳双键,碳碳叁键以及碳氧双键等) 聚合形成高分子的反应,其产物只有一种高分子化合物;凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换;所以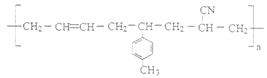 的单体为:
的单体为: 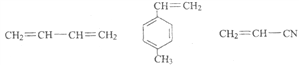 ;正确答案:
;正确答案: 。
。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,可生成一种淡黄色的固体F,E的L层电子数等于K、M层电子数之和。
(1)E在元素周期表中的位置__________,B常见氢化物的电子式为_______;F的电子式为________。
(2)B、C、D、E元素的简单离子半径由大到小的顺序为__________________ (用离子符号表示,下同)。A、B、C元素气态氢化物的稳定性由强到弱的顺序为_______________。
(3)已知A、E两种元素形成的化合物X,X结构与干冰相似,属于_________ (填“离子”或“共价”)化合物。
(4)用电子式表示D与E化合形成D2E的过程:_____________________。
(5)C和E分别能与氢形成18个电子的化合物,这两种化合物发生反应,可生成E单质,其反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠跟足量的 NaHCO3混合后,在密闭容器中充分加热,排净气体物质后冷却残留的固体物质是( )
A. Na2CO3 B. NaOH、Na2CO3
C. Na2O2、Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
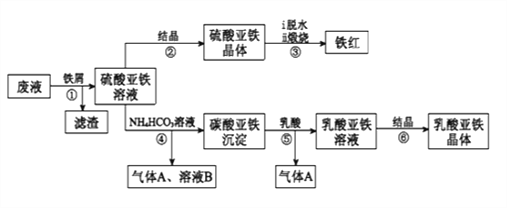
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______________(用a表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L 0.4mol/L HN03溶液中加入Fe粉和Cu粉的混合物9g,充分反应,放出NO气体且金属有剩余。则反应后溶液中c(NO3-)为(忽略溶液体积的变化)
A. 0. 2mol/L B. 0.225 mol/L C. 0.3mol/L D. 0.325 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),不会引起产物种类改变的是 ( )
A. Na和O2 B. NaOH和CO2 C. AlCl3和NaOH D. Na2O2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
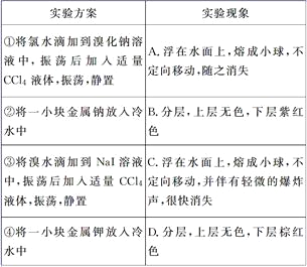
请你帮助该同学整理并完成实验报告。
(1)实验目的:_____________________。
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol·L-1溴化钠溶液、0.1 mol·L-1碘化钠溶液、四氯化碳等;
②仪器:________、________、________、镊子、小刀、玻璃片等。
(3)实验内容(填写与实验方案对应的实验现象的标号和化学方程式):________

(4)实验结论:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把40g含二氧化硅的碳酸钙固体在高温下加热到质量不再改变为止,冷却后称得质量为26.8g。求:
(1)生成的二氧化碳在标准状况下的体积为____升?
(2)原混合物中SiO2的质量为_____克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com