
海洋是一个巨大的化学资源宝库,下图是海水加工的示意图:
(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中试剂A的化学式 , 溶液中发生反应的化学方程式为 。
溶液中发生反应的化学方程式为 。
(3)制备金属镁是通过电解熔融的 ,而不用MgO,其原因是
,而不用MgO,其原因是
。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2。海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是 。
(1)蒸馏法、电渗析法
(2)Cl2 3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑
(3)MgO熔点很高,会消耗大量电能
(4)用试剂处理后的盐水中还含有少量的Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;防止H2与Cl2混合发生爆炸,同时防止Cl?进入阴极室,这样可以获得纯净的NaOH
解析试题分析:(1)海水淡化工厂通常采用的制备淡水的方法有:蒸馏法、电渗析法。
(2)A的作用为把Br?氧化为Br2,所以A为Cl2;Br2在Na2CO3溶液中发生歧化反应生成NaBr、NaBrO3,化学方程式为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑
(3)MgO的沸点大于MgCl2,会消耗大量电能,为节约能源,应电解熔融的MgCl2,而不用MgO
(4))用试剂处理后的盐水,杂质并没有除彻底,还含有少量的Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;阳离子交换膜只允许阳离子通过,Cl?、Cl2与H2不能通过,所以可防止H2与Cl2混合发生爆炸,同时防止Cl?进入阴极室,这样可以获得纯净的NaOH。
考点:本题考查制备淡水的方法、化学流程图的分析、化学方程式的书写、试剂的选择、交换膜的作用。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:单选题
下列有关海水综合利用的说法不正确是
| A.可用蒸馏或离子交换等方法淡化海水 |
| B.海水提溴只涉及物理变化 |
| C.利用海水可以制取金属Mg |
| D.开发海洋资源不能以牺牲环境为代价 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是 ( )
A.海水 Mg(OH)2 Mg(OH)2 Mg Mg |
B.海水 MgCl2溶液 MgCl2溶液 MgCl2熔融 MgCl2熔融 Mg Mg |
C.海水 Mg(OH)2 Mg(OH)2 MgO MgO Mg Mg |
D.海水 Mg(OH)2 Mg(OH)2 MgCl2溶液 MgCl2溶液  MgCl2熔融 MgCl2熔融 Mg Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨反应(N2+3H2 2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。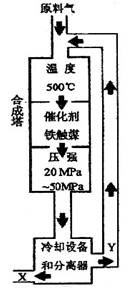
30. X的化学式为 ;X的状态为_______态。
31. 据右图分析,下列说法正确的是 (填写编号)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
32. 常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水的离子积常数的数值是_______________________;
② 将相同体积、相同物质的量浓度的氨水和盐酸混合后,
溶液中离子浓度由大到小依次为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河人海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:
(写一点即可)。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通人到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
①若吸收塔中的溶液含Br03-,则吸收塔中反应的离子方程式为: 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
技术的发展与创新永无止境,我国化工专家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下图:
(1)向沉淀池中要通入CO2和氨气,应先通入________(填化学式),原因是________________。
(2)沉淀池中发生的化学反应方程式是________________。
(3)母液中的溶质主要是________。向母液中通氨气后再加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,物质X是________,从沉淀池中提取沉淀的操作是________________。
(5)写出煅烧炉中发生反应的化学方程式____________________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是________(填化学式),为检验该杂质的存在,具体操作是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
石油和煤炭加工过程涉及多种技术和设备。
(1)石油分馏时,在不断向________(填工业设备名称)内投放原料的同时获得产品,该过程为________操作过程。
(2)石油裂化分为热裂化、________和加氢裂化,裂化的目的是提高________的产量。
(3)煤的洗选是为了降低原煤中灰分和________的含量。煤的流化床燃烧是指空气从底部吹向煤炭颗粒,并使全部煤炭颗粒________进行燃烧的过程。
(4)煤的直接液化是煤与适当溶剂混合后在高温和________存在下与________作用生成液体燃料的过程。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用___________________。
(2)脱色槽中应加入的物质X是_______________;设备A的作用是______________;设备B的名称为________________;设备C的作用是____________________。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是_____________。反应的化学方程式为_________________。
| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是
| A.制取NaHCO3的反应是利用其溶解度小于NaCl |
| B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C.在第③、④、⑤步骤中,溴元素均被氧化 |
| D.工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com