


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| A、AgCl(s)?Ag+(aq)+Cl-(aq) |
| B、Na2S═2Na++S2- |
| C、Ag2S(s)?2Ag+(aq)+S2-(aq) |
| D、PbI2(s)?Pb2+(aq)+2I-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3moL.L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
| B、标准状况下,22.4 L空气含有NA个单质分子 |
| C、1 L 0.1 mol/L氨水含有0.1NA个OH- |
| D、在18 g 18O2中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
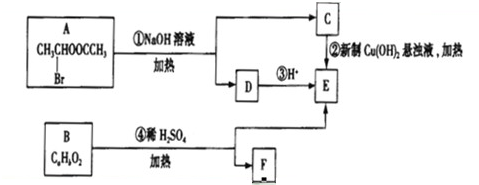
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫磺量不足 |
| B、生成了FeS |
| C、生成了Fe2S3 |
| D、有部分Fe被空气中的氧氧化了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com