
化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
A.氧化镁用作耐火材料
B.Na2O常用于潜水艇或呼吸面具的供氧剂
C.明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
D.FeCl3溶液可用于刻制印刷铜电路板
科目:高中化学 来源:2015届河南省顶级名校高三入学定位考试化学试卷(解析版) 题型:填空题
(11分)A、B、C、D、E、F、G、H、和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使 湿润的石蕊试纸变色;
②A和I相遇产生白烟
③B和E都能使品红溶液褪色
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟
⑤ 将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥ C和D相遇生成红棕色气体;
⑦ G在D中燃烧可以产生E和H2O
⑧ 将B和H 在瓶中混合后于光亮处放置几分钟,瓶内壁出现油状液滴并产生A。
回答下列问题:
(1)A的化学式是 ,②中白烟的化学式是 ;
(2) ④中发生反应的化学方程式是 ;
(3)⑤中发生反应的化学方程式是 ;
(4)C的化学式是 ,D的电子式是 ;
(5) ⑦中发生反应的化学方程式是 ;
(6) H的结构式是
查看答案和解析>>
科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:选择题
除去FeSO4溶液中少量的硫酸铁,可行的办法是
A.加入铁粉 B.加入铜粉
C.加入氢氧化钠溶液 D.滴入KSCN溶液
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三第一次调研考试化学试卷(解析版) 题型:选择题
体积为V mL,密度为d g/mL,溶质的摩尔质量为M g·mol-1,物质的量浓度为c mol·L-1,溶质的质量分数为a%,溶质的质量为m g。下列式子正确的是( )
A.m=aV/100d B.c=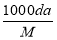
C.c=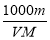 D.a%=
D.a%=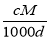 %
%
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三年级摸底考试理综化学试卷(解析版) 题型:填空题
(15分)高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O 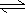 4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____ ________________。
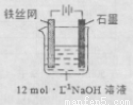
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O 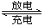 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为____ ,正极反应为:____ 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____ mol。
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:选择题
下列离子方程式中,正确的是
A.Na2S2O3溶液中加入稀硫酸:2S2O32 -+4H+=SO42 -+3S↓+2H2O
B.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
C.FeS溶于过量稀硝酸中:FeS + 2H+= Fe2+ + H2↑
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+2H+=I2+ 2H2O
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三暑期化学试卷(解析版) 题型:选择题
(9分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如下图表达。
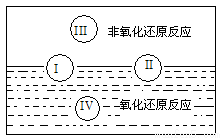
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:___________________,其中水为________剂
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl ____Cu+____CuCl2+N2↑+____H2O。
____Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10, 10C+P4O10===P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com