
研究化学反应原理对于生产生活是很有意义的。
(1)25℃时,醋酸溶液中CH3COOH CH3COO-+ H+;Ka= 1.75×10-5 mol/L,若向0.10 mol/LCH3COOH溶 液中加入一定量的固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0 mol/L,则溶液中c(H+)=_______mol/L(计算结果保留小数点后两位数字)。溶液中各种离子浓度关系是__________。
CH3COO-+ H+;Ka= 1.75×10-5 mol/L,若向0.10 mol/LCH3COOH溶 液中加入一定量的固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0 mol/L,则溶液中c(H+)=_______mol/L(计算结果保留小数点后两位数字)。溶液中各种离子浓度关系是__________。
(2)牙釉质对牙齿起着保护作用,其主要成分为Ca5(PO4)3OH,该物质在水中存在沉淀溶解平衡,试写出该物质的溶度积常数表达式Ksp=_____________。
(3)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。
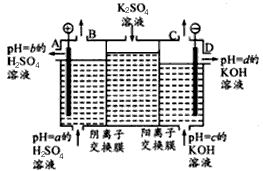
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
 (2010?潍坊一模)研究化学反应原理对于生产生活是很有意义的.
(2010?潍坊一模)研究化学反应原理对于生产生活是很有意义的.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 研究化学反应原理对于生产、生活及环境保护具有重要意义.
研究化学反应原理对于生产、生活及环境保护具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
研究化学反应原理对于生产生活是很有意义的。
(1)下列关于醋酸的叙述正确的是 (填写符号)。
a.等体积等pH的醋酸和盐酸完全被NaOH溶液中和,消耗NaOH的物质的量一样多
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度比纯水的小
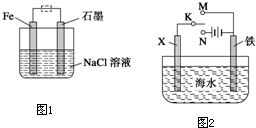
(2)钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:
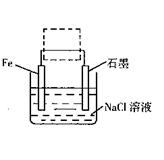
①写出石墨电极的电极反应式 ;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改。
③写出修改后石墨电极的电极反应式 。
(3)①高炉炼铁过程中会发生反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)。
Fe(s)+CO2(g)。
已知:Fe(s)+1/2O2(g)=FeO(s)△H= -272kJ·mol-1
C(s)+O2(g)=CO2(g) △H= -393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H= -22lkJ·mol-1
则:①FeO(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
△H= 。
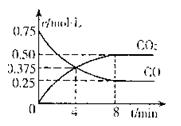
②一定温度下,向某密闭容器中加人足量FeO,
并充人一定量的CO气体,反应过程中CO和CO2的
浓度与时间的关系如图所示则从开始至达到平衡过程中,![]() (CO)= 。
(CO)= 。
(4)铁红是一种红色颜料,其成份是Fe2O3。将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为 。
查看答案和解析>>
科目:高中化学 来源:2011届河南省郑州外国语高三上学期第二次月考(理综)化学部分 题型:填空题
研究化学反应原理对于生产生活是很有意义的。
(1)下列关于醋酸的叙述正确的是 (填写符号)。
a.等体积等pH的醋酸和盐酸完全被NaOH溶液中和,消耗NaOH的物质的量一样多
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度比纯水的小
(2)钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:
①写出石墨电极的电极反应式 ;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改。
③写出修改后石墨电极的电极反应式 。
(3)①高炉炼铁过程中会发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)。
Fe(s)+CO2(g)。
已知:Fe(s)+1/2O2(g)=FeO(s)△H= -272kJ·mol-1
C(s)+O2(g)=CO2(g) △H= -393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H= -22lkJ·mol-1
则:①FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
△H= 。
②一定温度下,向某密闭容器中加人足量FeO,
并充人一定量的CO气体,反应过程中CO和CO2的
浓度与时间的关系如图所示则从开始至达到平衡过程中, (CO)= 。
(CO)= 。
(4)铁红是一种红色颜料,其成份是Fe2O3。将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com