
����Ŀ�����������ﱻ����Ԥ��ȣ�ݡ���ˮ�ӷ���������ǻ������Ʒ�С�������÷����ƣ�NaF����Ϊ����ˮ�ӷ����������������ᣨH2SiF6�������η������ƣ�Na2SiF6�����档���������գ�
(1)д��Fԭ�ӵĵ����Ų�ʽ_____________��Fԭ����_______��������ͬ�ĵ��ӡ�
(2)��Ԫ��λ��ͬ���������һ��������Ԫ�ص����������Ľṹ��ʽ��__________�����۵�_____SiO2��������������������������
(3)F�ķǽ����Ա�Clǿ��������һ����ʵ��֤����________________________________��
�ڲ���ԭ�ӽṹ�ǶȽ��н��ͣ�______________��
���𰸡�1s22s22p5 3 O=C=O ���� �ֱ���������Ӧ��F2������ F��Cl����ͬ���壬���ϵ��£�ԭ�Ӻ�����Ӳ������࣬ԭ�Ӱ뾶����F�õ��ӵ�����ǿ��Cl����˷ǽ�����Fǿ��Cl
��������
![]() ��Ԫ�����ڱ��е�9��Ԫ�أ�λ�ڵڶ����ڢ�A�壬�Ƿǽ�����ǿ��Ԫ�أ��ǰ뾶��С��ԭ�ӣ�����ԭ���⣩��
��Ԫ�����ڱ��е�9��Ԫ�أ�λ�ڵڶ����ڢ�A�壬�Ƿǽ�����ǿ��Ԫ�أ��ǰ뾶��С��ԭ�ӣ�����ԭ���⣩��
��1��![]() ԭ�ӵĵ����Ų�ʽΪ1s22s22p5���ʺ���3��������ͬ�ĵ��ӡ�
ԭ�ӵĵ����Ų�ʽΪ1s22s22p5���ʺ���3��������ͬ�ĵ��ӡ�
����1s22s22p5��3��
��2����Ԫ��λ��ͬ���������һ��������Ԫ��Ϊ̼�������������Ϊ������̼���ṹ��ʽΪ��![]() ��������̼Ϊ���Ӿ��壬��������Ϊԭ�Ӿ��壬�ʶ�����̼���۵���ڶ������裬
��������̼Ϊ���Ӿ��壬��������Ϊԭ�Ӿ��壬�ʶ�����̼���۵���ڶ������裬
��Ϊ��![]() �����ڣ�
�����ڣ�
��3����֤���ǽ�����ǿ�����Կ���������Ӧ�ľ��ҳ̶ȣ������������������ܷ�����ը��������������Ӧ��Ҫ���ջ��ȼ������֤�����ķǽ����Ա���ǿ��
��Ϊ���ֱ���������Ӧ��F2�����ף�
�ڴ�ԭ�ӽṹ�Ƕȿ���![]() ��
��![]() ����ͬ���壬���ϵ��£�ԭ�Ӻ�����Ӳ������࣬ԭ�Ӱ뾶����
����ͬ���壬���ϵ��£�ԭ�Ӻ�����Ӳ������࣬ԭ�Ӱ뾶����![]() �õ��ӵ�����ǿ��
�õ��ӵ�����ǿ��![]() ����˷ǽ�����
����˷ǽ�����![]() ǿ��
ǿ��![]() ��
��
�ʴ�Ϊ��![]() ��
��![]() ����ͬ���壬���ϵ��£�ԭ�Ӻ�����Ӳ������࣬ԭ�Ӱ뾶����
����ͬ���壬���ϵ��£�ԭ�Ӻ�����Ӳ������࣬ԭ�Ӱ뾶����![]() �õ��ӵ�����ǿ��
�õ��ӵ�����ǿ��![]() ����˷ǽ�����
����˷ǽ�����![]() ǿ��
ǿ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���NaOH��Һ�ֱ�ӵ�HA��HB����������Һ�У�����Һ��pH������Ũ�ȱ�ֵ�Ķ�����ϵ��ͼ��ʾ����֪![]() �������й�����������ǣ� ��
�������й�����������ǣ� ��

A.HA��HB��������HB����������HA
B.b��ʱ��![]()
C.ͬŨ��ͬ�����NaA��NaB��Һ�У��������������
D.��HB��Һ�м���NaOH��Һ���õĻ����Һ�У�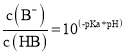
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȼ��2.8gij�л���A������8.8g CO2��3.6g H2O�������л�������������ܶ�����ͬ������N2��2����
��1������л���ķ���ʽ��
��2�����л�����״ͬ���칹��Ľṹ��ʽΪ�� ��
��3�����ں˴Ź���������ֻ��һ���źŷ壨��ֻ��һ����ԭ�ӣ������ü���ʽ��ʾ�Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����ȵġ��ݻ��̶����ܱ������У��������淴ӦmA(g)��nB(g)![]() pC(g)��qD(g)(m��n��p��qΪ����������)��������˵���ÿ��淴Ӧ�ﵽƽ��״̬����(����)
pC(g)��qD(g)(m��n��p��qΪ����������)��������˵���ÿ��淴Ӧ�ﵽƽ��״̬����(����)
�ٻ��������ܶȲ��ٷ����仯������ϵ���¶Ȳ��ٷ����仯����A��ת���ʲ��ٸı䡡�ܸ���ֵİٷֺ������ٸı䡡�ݷ�Ӧ����v(A)��v(B)��v(C)��v(D)��m��n��p��q
A. �ڢۢ�B. �٢ۢ�C. �ڢܢ�D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��һ�����۵�̼��Դ�����ۺ����þ�����Ҫ���塣
��һ��CO2�Ļ�ѧ����
��1��CO2���Ա�NaOH��Һ������������ҺpH=13��CO2��Ҫת��Ϊ___��д��̼���ӷ��ţ����������£�H2CO3��Ka1=4.3��10��7��Ka2=5.6��10��11��
��2��������������أ�SOEC�����ڸ��¹����CO/H2���ȿ�ʵ��CO2�ļ����ֿɸ�Ч�Ʊ��ϳ�����CO/H2�����乤��ԭ����ͼ��д���缫A�����ĵ缫��Ӧʽ___��

������CO2���ۺ�����
��1��CO2��CH4���������Ƶúϳ�����
��Ӧ��CH4��g��H+CO2��g��2CO��g��+2H2��g����H1
��֪������һ����̼�ͼ���ı�ȼ���ȣ�25�棩�����ʾ
���� | H2��g�� | CO��g�� | CH4��g�� |
��ȼ���ȡ�H/kJmol��1 | ��285.8 | ��283.0 | ��890.3 |
��ӦI�ġ�H=___kJmol��1��
��2����CO2��������ȡ�����ѵķ�ӦΪ����Ӧ��.2CO2��g��+6H2��g��CH3OCH3��g��+3H2O��g������10L�����ܱ������У�������2mol CO2��6moH2���ֱ���ҿ��Ir�����棨Ce������������Ӧ������ͬ��ʱ����õ�CO2��ת��������CO2���淴Ӧ�¶ȵı仯�����ͼ1��
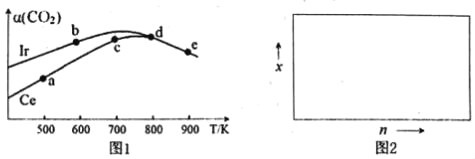
�ٸ���ͼ1������˵������ȷ����___��
A����Ӧ��ġ�H��0����S��0
B����Ir��Ce������ʱ����Ӧ��Ļ�ܸ��͵���Ce
C��״̬dʱ��v��������v���棩
D����״̬b��d������CO2����������С����С��ԭ��������¶�����ƽ�������ƶ�
��״̬e��900K��ʱ������CO2��=50%�����ʱ��ƽ�ⳣ��K=___��
����H2��CO2�����ʵ���֮��Ϊn��1��900Kʱ��Ӧƽ����ϵ�ж����ѵ����ʵ�������Ϊx������ͼ2�л���x��n�仯��ʾ��ͼ��_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���A�ĺ�����ͺ˴Ź�����������ͼ��ʾ������˵���д������
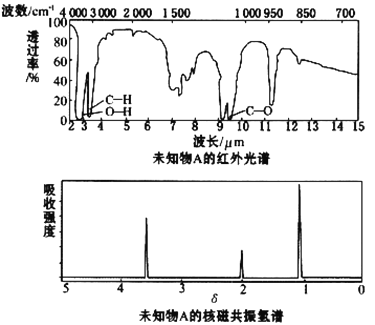
A.�ɺ������֪�����л��������ٺ������ֲ�ͬ�Ļ�ѧ��
B.�ɺ˴Ź�������֪�����л�������������ֲ�ͬ����ԭ��
C.������˴Ź�������֪������е���ԭ������
D.��A�Ļ�ѧʽΪC2H6O������ṹ��ʽΪCH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol/LNa2SO3��Һ�������ٽ��£��ⶨ�¶ȱ仯�����е�pH���������£�
ʱ�� | �� | �� | �� | �� |
�¶�/�� | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
��1����ʱ��Na2SO3��Һ��ˮ�ĵ���̶�________ͬ���´�ˮ��ˮ�ĵ���̶ȣ�����>������<������=������Ӧ��ƽ��ԭ������ԭ��_______________________________��
��2���ܵ�pH��С�ڢ�������_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǰ�ºϳɵ��黯����ά���Ͼ��г�ǿ�����ԣ����ֲ��ϵĵ���������ʯīϩ�൱���ɴ���ʯīϩʹ�á�
��1��Cd��Znͬ�������ڣ���Cd��̬ԭ�ӽ������1��d���Ӽ�������������np�ܼ����������̬ԭ�ӵ���Χ�����Ų�ʽΪ___��
��2������(As)ͬ�����N��P����Ԫ�ص��⻯��ˮ��Һ�ļ��ԣ�NH3ǿ��PH3��������ԭ����___��
��3��As��Ge��Se�ĵ�һ�������ɴ�С��˳��Ϊ___����Ԫ�ط��ű�ʾ����
��4�������л������������������Ľṹ��ʽ��ͼ������Cԭ�ӹ���ӻ�����Ϊ___��1mol���������Ậ������ĿΪ___��
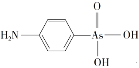
��5���黯�ӿ��Կ�����ʯīϩ��3D�棬�侧���ṹ��ͼ��AsΪ���������ѻ���Cdռ��AsΧ�ɵ��������϶����϶ռ����75%����ͼ��������������λ������λ�������黯�ӻ�ѧʽΪ___��
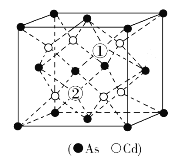
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��ϳ�����ҩ��ҵ�е���Ҫ�ֶΡ�G��ij����֢ҩ����м��壬��ϳ�·����ͼ��
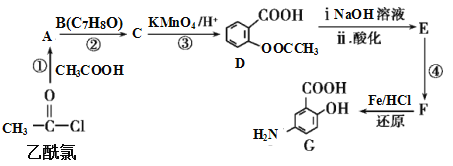
��֪��
 ��
��
��1��B�Ľṹ��ʽΪ_____��
��2����Ӧ�ܵ�����Ϊ____���ٵķ�Ӧ����Ϊ___����Ӧ�ڵ�������____��
��3�����ж��л���G�������Ʋ���ȷ����____(��ѡ����ĸ)��
A.�������ԣ��������ᷴӦҲ����Ӧ
B.�ܷ�����ȥ��Ӧ��ȡ����Ӧ��������Ӧ
C.�ܾۺϳɸ߷��ӻ�����
D.1mol G������NaHCO3��Һ��Ӧ�ų�2mol CO2
��4��D��������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ_____��
��5����������������C��ͬ���칹����___�֡�
A.���ڷ����廯����Һ��������� B.�ܷ���������Ӧ C.��FeCl3��Һ������ɫ��Ӧ
���к˴Ź���������4��壬�ҷ����֮��Ϊ6��2��1��1����___(д������һ�ֵĽṹ��ʽ)��
��6����֪����������������ʱ���������ȡ�������ڱ������ڡ���λ�����������Ȼ�ʱ���������ȡ�������ڱ����ļ�λ���������е���Ϣ��д���Լױ�Ϊԭ�Ϻϳ��л���![]() ������ͼ(���Լ���ѡ)��_______
������ͼ(���Լ���ѡ)��_______
�ϳ�·������ͼʾ����ͼ��X![]() Y
Y![]() Z��Ŀ�����
Z��Ŀ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com