
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
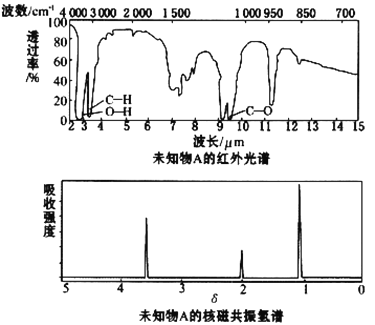
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由其核磁共振氢谱可知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3CH2OH
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量的叙述正确的是![]()
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.己知![]() 白磷,
白磷,![]() 红磷,
红磷,![]() ,则白磷比红磷稳定
,则白磷比红磷稳定
C.对于某一化学反应,当生成物中化学键形成时所吸收的能量大于反应物中化学键断裂所释放的能量时,该反应为吸热反应,![]()
D.若![]() ,
,![]()
![]() ,则含
,则含![]() gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于
gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于![]() kJ
kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A. 溶液的pH增大
B. CH3COOH电离度增大
C. 溶液的导电能力减弱
D. 溶液中c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生如图所示一系列变化,则下列说法错误的是

A. A分子中所有原子均在同一平面内
B. A→B所用试剂为![]()
C. 分子式为![]() 的酯有3种
的酯有3种
D. 等物质的量的B、D分别与足量钠反应生成气体的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氟化合物被用于预防龋齿、饮水加氟及其他口腔卫生产品中。起初是用氟化钠(NaF)来为饮用水加氟,但后来逐渐被氟硅酸(H2SiF6)及其盐氟硅酸钠(Na2SiF6)代替。完成下列填空:
(1)写出F原子的电子排布式_____________,F原子有_______种能量不同的电子。
(2)和硅元素位于同主族的另外一个短周期元素的最高氧化物的结构简式是__________,其熔点_____SiO2(填“高于”或“低于”)。
(3)F的非金属性比Cl强,①请用一个事实来证明:________________________________。
②并从原子结构角度进行解释:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确表示下列反应的离子反应方程式为
A.向FeBr2溶液中通入足量氯气:2Fe2++4Br﹣+3Cl2═2 Fe3++2 Br2+6Cl﹣
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:![]()
C.![]() 稀溶液与过量的KOH溶液反应:
稀溶液与过量的KOH溶液反应:![]()
D.醋酸除去水垢:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极解饱和氯化钠溶液,通电时,为使Cl2被完成吸收投篮有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液和主要成分判断正确的是( )
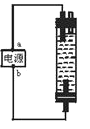
A.a为正极,b为负极:NaClO和NaCl
B.a为负极,b为正极:NaClO和NaCl
C.a为阳极,b为阴极:HClO和NaCl
D.a为阴极,b为阳极:HClO和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
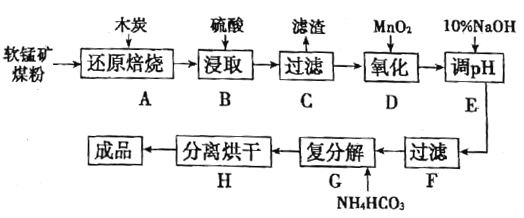
已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热;步骤C中的滤渣为__________。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为__________,其目的是__________。
(4)步骤G,温度控制在35℃以下的原因是__________,若Mn2+恰好沉淀完全时测得溶液中![]() 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是__________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中![]() 完全转化为
完全转化为![]() );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应![]() +
+![]() =N2↑+2H2O以除去
=N2↑+2H2O以除去![]() ;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO
;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO![]() ;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程为__________。
②试样中锰元素的质量分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com