
【题目】已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生如图所示一系列变化,则下列说法错误的是

A. A分子中所有原子均在同一平面内
B. A→B所用试剂为![]()
C. 分子式为![]() 的酯有3种
的酯有3种
D. 等物质的量的B、D分别与足量钠反应生成气体的量相等
【答案】C
【解析】
依题意可得气态烃A的相对分子质量为14×2=28,即A为乙烯,由B连续催化氧化可知,B为乙醇,C为乙醛,D为乙酸,则E为乙酸乙酯。A与水发生加成反应得到乙醇,据此分析解答。
A.乙烯为平面结构,所以所有原子在同一平面内,故A正确;
B.乙烯与水发生加成反应得到乙醇,故B正确;
C.分子式为C4H8O2且含酯基的同分异构体有4种,即HCOOCH2CH2CH3、HCOOCH(CH3)CH3、CH3COOCH2CH3和CH3CH2COOCH3,故C错误;
D.金属钠能与醇羟基反应放出氢气,也能与羧基反应放出氢气,而乙醇和乙酸中都只有一个活泼氢原子,因此等物质的量乙醇和乙酸与足量钠反应生成气体的量是相等的,故D正确;
故选C。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
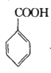
【题目】苯甲酰氯(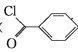 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 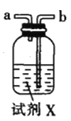 乙.
乙. 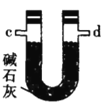 丙.
丙. 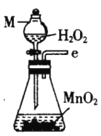 丁.
丁.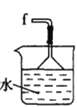 戊.
戊. 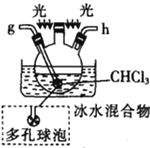
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
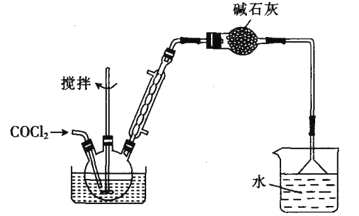
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
浓度c/mol/L | 0.1 | 0.1 | 0.1 | 0.1 |
溶液 | 氨水 | CH3COONa溶液 | 醋酸 | 盐酸 |
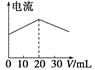
A.在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如下图
B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO-)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
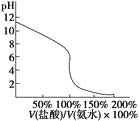
D.用④滴定①,滴定曲线如下图,可用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质分子式都是C7H8O,若滴入FeCl3溶液,只有C呈紫色;若投入金属钠,只有B没有变化。
(1)写出A、B的结构简式:A______________________,B________________。
(2)A、C都能与Na、NaOH反应吗?A、C都能与NaHCO3反应吗?若能反应,完成它们的化学方程式(若有同分异构体,只写出其中一种所发生反应的化学方程式即可) ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
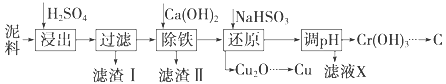
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下图:
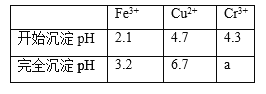
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
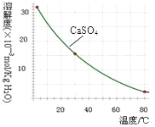
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到__;②将浊液加热到80℃,______.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式___________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是________.
(4)当离子浓度≤1×10﹣5 molL﹣1认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH﹣)≥_______.已知:Ksp[Cr(OH)3]=6.3×10﹣31,![]() ≈4.0)
≈4.0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 溶液与
溶液与![]() 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题
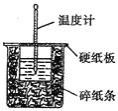
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是__________________。
(2)烧杯间填满碎纸条的作用是__________________。
(3)实验数据如下表:
温度 实验 次数 | 起始温度 | 终止温度 | 温度差平均值 | ||
| KOH | 平均值 | |||
1 |
|
|
|
| |
2 |
|
|
|
| |
3 |
|
|
|
| |
4 |
|
|
|
| |
![]() 本次实验的温度差的平均值
本次实验的温度差的平均值![]() _________
_________![]() 。
。
![]() 近似地认为
近似地认为![]() 溶液和
溶液和![]() 溶液的密度都是
溶液的密度都是![]() ,中和后生成溶液的比热容
,中和后生成溶液的比热容![]() ,则中和热
,则中和热![]() _________
_________![]() 数值精确到
数值精确到![]() 。
。
![]() 中和热测定实验中,下列操作一定会降低实验准确性的是_________。
中和热测定实验中,下列操作一定会降低实验准确性的是_________。
![]() 用滴定管
用滴定管![]() 精量仪器,读数保留到
精量仪器,读数保留到![]() 取所用酸碱溶液的体积
取所用酸碱溶液的体积
![]() 溶液在倒入小烧杯时,有少量溅出
溶液在倒入小烧杯时,有少量溅出
![]() 大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
![]() 测量
测量![]() 溶液的温度计用水洗净后才用来测KOH溶液的温度
溶液的温度计用水洗净后才用来测KOH溶液的温度
(4)实验中改用![]() 盐酸跟
盐酸跟![]() 溶液进行反应,与上述实验相比,所放出的热量_________
溶液进行反应,与上述实验相比,所放出的热量_________![]() 填“相等”或“不相等”
填“相等”或“不相等”![]() ,所求中和热_________
,所求中和热_________![]() 填“相等”或“不相等”
填“相等”或“不相等”![]() 。
。
(5)若用![]() 溶液进行上述实验,测得的中和热的数值会_________
溶液进行上述实验,测得的中和热的数值会_________![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有_________、___________。
Ⅱ.测定中和热的实验装置如下图所示。
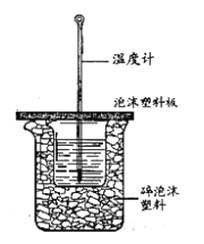
(3)大小烧杯之间填满碎泡沫塑料的作用是________,从实验装置上看,图中缺少的一种玻璃仪器________。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____℃ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②通过计算可得中和热△H=___________(精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是____。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_________(填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理后的排放情况。
I、实验室通过如图所用的装置制备Na2S2O3
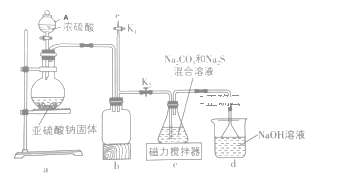
(1)仪器A的名称___,使用前注意的事项___。
(2)b装置的作用是___。
(3)装置a中发生反应的化学方程式____。
(4)反应开始后,c中先有淡黄色浑浊产生,此浑浊物为___(填化学式);反应后剩余的SO2全部被d中的氢氧化钠溶液吸收,若恰好生成酸式盐,反应后的溶液呈___(“酸”或“碱”)性,原因是___。
II、已知:废水中氰化钠的最高排放标准为0.50mg/L。
(1)向氰化钠溶液中通入少量CO2能发生反应:NaCN+CO2+H2O=HCN+NaHCO3,浓度相同①NaCN、②Na2CO3、③NaHCO3三种溶液pH值由大到小的顺序(用序号表示):___。
(2)工业上常用碱性氯化法处理含氰废水,其原理如下:第一步,NaCN与NaClO反应,生成NaOCN和NaCl;第二步,NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。某工厂含氰废水中NaCN的含量为1.47mg/L,处理10m3这样的废水,理论上需要5mol/LNaClO溶液___L处理后才可以进行排放。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com