
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有_________、___________。
Ⅱ.测定中和热的实验装置如下图所示。
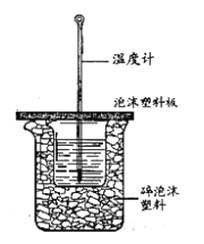
(3)大小烧杯之间填满碎泡沫塑料的作用是________,从实验装置上看,图中缺少的一种玻璃仪器________。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____℃ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②通过计算可得中和热△H=___________(精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是____。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_________(填“偏大”、“偏小”、“不受影响”)。
【答案】5.0 250mL 容量瓶 胶头滴管 保温、隔热、减少实验过程中的热量损失 环形玻璃搅拌棒或环形玻璃搅拌器 3.4 —56.8kJ/mol A、C、D 不相等 相等 偏小
【解析】
Ⅰ.(1)若实验中大约要使用245 mL NaOH溶液,由于与该体积最接近的容量瓶是250mL,因此至少需要称量NaOH固体是(0.50 mol/L×0.25L)×40g/mol=5.0g;
(2)配制物质的量浓度的溶液过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有250ml容量瓶、胶头滴管;
Ⅱ.(3)大小烧杯之间填满碎泡沫塑料的作用是保温、隔热、减少实验过程中的热量损失;从实验装置上看,图中缺少的一种玻璃仪器环形玻璃搅拌棒或环形玻璃搅拌器;
(4)①四组实验的温度差值是:3.4℃、6.1℃、3.3℃、3. 5℃,可见第二次实验数据偏差太大,应该舍去,平均温度是:(3.4℃+3.3℃+3. 5℃)÷3=3.4℃;
②反应过程中放出的热量Q=c·m·Δt=4.18J/(mol·g·℃)×100g×3.4℃×10-3 kJ/J=1.421KJ,n(H+)= 0.05L×0.25mol/L×2=0.025mol;n(OH-)=0.05L×0.55 mol/L=0.02750 mol>0.025mol,所以发生中和反应的物质的量应该以不足量的酸为标准,中和热△H=![]() = -56.8kJ/mol;
= -56.8kJ/mol;
③A.实验装置保温、隔热效果差,使热量部分散失,导致中和热偏低,正确;
B.量取NaOH溶液的体积时仰视读数,则NaOH的物质的量偏多,使热量产生的多,则中和热偏多,错误;
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,则在测量过程中热量会部分散失,导致中和热偏低,正确;
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,则在测量酸时就一部分反应放出,使热量部分散失,导致中和热偏低,正确。因此选项是A、C、D;
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,则n(H+)= 0.06L×0.25mol/L×2=0.003mol>0.02750 mol,所以放出的热量应该以酸为标准;由于反应的物质增多,所以与上述实验相比,所放出的热量就不相等;但是所求中和热由于是产生1mol的水时放出的热量,因此不会发生变化;若用50 mL 0.50 mol/L醋酸代替H2SO4溶液进行上述实验,由于醋酸是弱酸,电离需要吸收热量,因此发生酸碱中和反应放出的热量就少,则测得反应前后温度的变化值会减小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的表示及说法正确的是
A.已知![]() 石墨,
石墨,![]() 金刚石,
金刚石,![]() ,则金刚石比石墨稳定
,则金刚石比石墨稳定
B.已知![]() ,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
C.HCl和NaOH反应的中和热为![]() ,则
,则![]() 和
和![]() 反应的中和热
反应的中和热![]()
D.已知I2(g)+H2(g)==2HI(g) △H1;I2(s)+H2(s)==2HI(g) △H2 则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸己酯分子式为C13H18O3,具有花果香味,用作化妆品香料的定香剂,也用作烟草香精。它的一种同分异构体A具有如下转化关系:
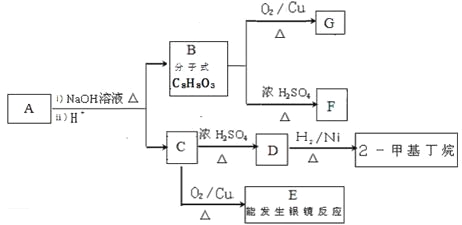
已知:
①C分子中有一个碳原子连接着4个不同的原子或原子团,且1 molC和足量金属Na反应能产生0.5 mol H2
②F中除了含有1个苯环外,还含有1个五元环
(1)写出B的结构简式___________________;写出G含有的官能团的名称_______________
(2)写出A和NaOH溶液反应的化学方程式_________________________________;
写出E发生银镜反应的化学方程式_______________________________________;
(3)B生成F的反应类型是________________;C生成D的反应类型是________________;
(4)化合物B有多种同分异构体,写出两种符合下列条件的同分异构体的结构简式:
_______________________________________________
a.属于芳香族化合物
b.酸性条件下能发生水解反应且其中一种产物的苯环上的一氯代物只有两种
c.1 mol该有机物最多可消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生如图所示一系列变化,则下列说法错误的是

A. A分子中所有原子均在同一平面内
B. A→B所用试剂为![]()
C. 分子式为![]() 的酯有3种
的酯有3种
D. 等物质的量的B、D分别与足量钠反应生成气体的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为实验室制取少量乙酸乙酯的装置。下列关于该实验的叙述不正确的是( )
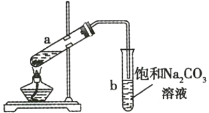
A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
B.试管b中导气管下端管口不能浸入液面下的原因是防止实验过程中发生倒吸
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.试管b中饱和![]() 溶液的作用之一是吸收乙酸乙酯
溶液的作用之一是吸收乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在漂白液中:Ag+、K+、NO3-、SO32-
B.K+、Na+、Br-、AlO2-在溶液中能大量共存,通入过量的CO2后仍能大量共存
C.![]() =1012的溶液中,NH4+、Ca2+、Cl-、NO3-
=1012的溶液中,NH4+、Ca2+、Cl-、NO3-
D.由水电离的c(H+)=1×10-10mol/L的溶液中:K+、Na+、HCO3-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol某烃在氧气中充分燃烧,需要消耗氧气24.64L(标准状况下)。它在光照条件与氯气反应能生成四种一氯取代物。则该烃的结构简式可能是
A.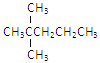
B.CH3CH2CH2CH2CH3
C.![]()
D.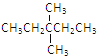
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。
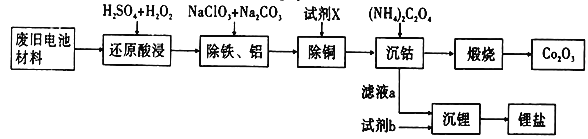
已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中钴酸锂反应的离子方程式________________________________________;温度通常控制在40℃以下的原因是_______________________________________________。
(2)“除铝铁”过程的两种试剂的作用分别是____________________,______________________。
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式______________________________。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
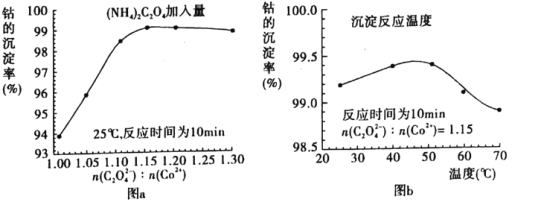
①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因________________________________________________________________________。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
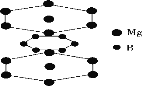
【题目】下面的排序不正确的是( )
A.晶体熔点高低:对羟基苯甲醛>邻羟基苯甲醛
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为MgB2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com