
【题目】下面的排序不正确的是( )
A.晶体熔点高低:对羟基苯甲醛>邻羟基苯甲醛
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
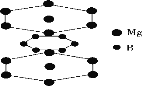
D.硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为MgB2
【答案】C
【解析】
A.由于对羟基苯甲醛能形成分子间氢键,熔点升高,而邻羟基苯甲醛易形成分子内氢键,故对羟基苯甲醛的熔点高于邻羟基苯甲醛,故A正确;
B. 金刚石、碳化硅、晶体硅均为原子晶体,其硬度与晶体中共价键的键长有关,一般键长越短,硬度越大,三者的键长是:C-C<C-Si <Si-Si,故硬度是金刚石>碳化硅>晶体硅,B正确;
C. Na、Mg、Al均属于金属晶体,其熔点与金属离子半径和金属离子所带的电荷成正比,离子半径是:r(Na+)>r(Mg2+)>r(Al3+),所带电荷是Na+<Mg2+<Al3+,故熔点是:Na<Mg<Al,故C错误;
D.由晶胞图可知,Mg位于六棱柱的12个顶点和上下底面心中,故一个晶胞中Mg的数目为:![]() ,而六个硼原子均位于晶胞的体内,故一个晶胞中的硼原子个数为:
,而六个硼原子均位于晶胞的体内,故一个晶胞中的硼原子个数为:
![]() ,故这种超导材料的化学式为MgB2,故D正确;
,故这种超导材料的化学式为MgB2,故D正确;
本题答案为:C。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有_________、___________。
Ⅱ.测定中和热的实验装置如下图所示。
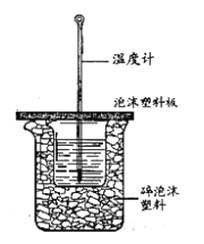
(3)大小烧杯之间填满碎泡沫塑料的作用是________,从实验装置上看,图中缺少的一种玻璃仪器________。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____℃ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②通过计算可得中和热△H=___________(精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是____。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_________(填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
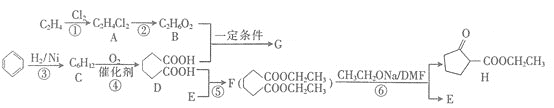
【题目】聚酯增塑剂广泛应用于耐油电缆、煤气管、防水卷材、电气胶带、耐油耐汽油的特殊制品等。聚酯增塑剂G及某医药中间体H的一种合成路线![]() 部分反应条件略去
部分反应条件略去![]() 如下:
如下:
已知:
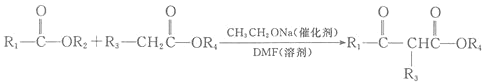 +R2OH
+R2OH
![]() 中的官能团名称是________。
中的官能团名称是________。
![]() 的名称
的名称![]() 系统名称
系统名称![]() 为________,H的分子式为________。
为________,H的分子式为________。
![]() 写出下列反应的反应类型:反应
写出下列反应的反应类型:反应![]() 是________,反应
是________,反应![]() 是________。
是________。
![]() 的结构简式为________。
的结构简式为________。
![]() 写出反应
写出反应![]() 的化学方程式:________。
的化学方程式:________。
![]() 存在多种同分异构体,写出核磁共振氢谱只有两组吸收峰的同分异构体的结构简式:________。
存在多种同分异构体,写出核磁共振氢谱只有两组吸收峰的同分异构体的结构简式:________。
![]() 利用以上合成路线的信息,某同学合成了
利用以上合成路线的信息,某同学合成了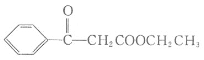 ,其路线如下:
,其路线如下:
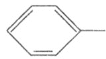
I(C7H8)![]() J(C7H6O2)
J(C7H6O2)![]()
 COOCCH2CH3
COOCCH2CH3![]()
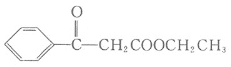
则I、K的结构简式分别为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理后的排放情况。
I、实验室通过如图所用的装置制备Na2S2O3
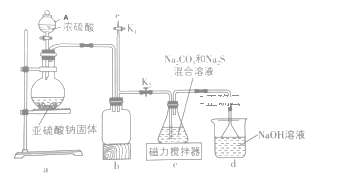
(1)仪器A的名称___,使用前注意的事项___。
(2)b装置的作用是___。
(3)装置a中发生反应的化学方程式____。
(4)反应开始后,c中先有淡黄色浑浊产生,此浑浊物为___(填化学式);反应后剩余的SO2全部被d中的氢氧化钠溶液吸收,若恰好生成酸式盐,反应后的溶液呈___(“酸”或“碱”)性,原因是___。
II、已知:废水中氰化钠的最高排放标准为0.50mg/L。
(1)向氰化钠溶液中通入少量CO2能发生反应:NaCN+CO2+H2O=HCN+NaHCO3,浓度相同①NaCN、②Na2CO3、③NaHCO3三种溶液pH值由大到小的顺序(用序号表示):___。
(2)工业上常用碱性氯化法处理含氰废水,其原理如下:第一步,NaCN与NaClO反应,生成NaOCN和NaCl;第二步,NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。某工厂含氰废水中NaCN的含量为1.47mg/L,处理10m3这样的废水,理论上需要5mol/LNaClO溶液___L处理后才可以进行排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.实验室用大理石和稀盐酸制取CO2:2H++CO32-= CO2↑+H2O
B.氯气与水反应:Cl2+H2O = 2H++Cl-+ClO-
C.用氢氧化钠检验氯化铵溶液中铵根离子:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D.氯化铝溶液加入氨水:Al3++3OH-= Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是研制某种治疗白血病的新药所需的一种重要中间体,可有下列路线合成:
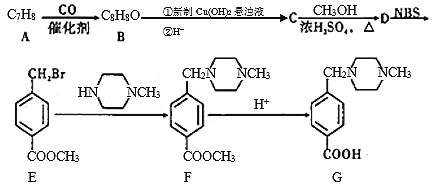
请根据上述合成信息回答下列有关问题:
(1)![]() 的结构简式为: ______
的结构简式为: ______
(2)E中所含官能团的名称是: ______ ,![]() 反应类型是: ______
反应类型是: ______
(3)可满足下列条件D的同分异构体共有______种,其中的![]() 种物质的结构简式是:______
种物质的结构简式是:______
![]() 二取代苯
二取代苯![]() 含有醛基
含有醛基![]() 能与
能与![]() 溶液发生显色反应
溶液发生显色反应
(4)完成下列反应方程式:
![]() 与足量的NaOH水溶液共热 ______
与足量的NaOH水溶液共热 ______
![]() 先在强碱溶液中充分水解后再酸化,利用所得产物合成高聚物的化学方程式为 ______
先在强碱溶液中充分水解后再酸化,利用所得产物合成高聚物的化学方程式为 ______
(5)![]() 结构简式为
结构简式为![]() ,则关于NBS与D反应生成E的说法错误的是 (_____)
,则关于NBS与D反应生成E的说法错误的是 (_____)
![]() 该反应是加成反应
该反应是加成反应
![]() 的核磁共振氢谱中有一组吸收峰
的核磁共振氢谱中有一组吸收峰
![]() 加入适当的溶剂可以加快该反应的速率
加入适当的溶剂可以加快该反应的速率
![]() 与液溴反应也能转化为纯净的E,只是会造成污染
与液溴反应也能转化为纯净的E,只是会造成污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以对羟基苯甲醛为原料,合成降血脂药物环丙贝特的流程图如下:

已知: 
请回答下列问题:
(1)下列说法不正确的是___________。
A.环丙贝特分子中存在2个手性碳原子 B. D的分子式为C14H16Cl2O3
C.C中含有的官能团有醚键、酯基和碳碳双键 D.反应②③⑤均为取代反应
(2)B的结构简式为____________ 。
(3)写出A与足量溴水反应的化学方程式为____________ 。
(4)请写出符合下列条件的A的所有同分异构体的结构简式____________ 。
i分子中含有苯环,不含其他环状结构
ii 1H-NMR谱显示共有4个峰
(5)已知:①
②苯环上有甲基时,新取代基主要取代在邻位或对位,有醛基时主要取代在间位。请写出以甲苯为原料合成![]() 的流程图,其他无机原料任选。__________________
的流程图,其他无机原料任选。__________________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四种金属堆积模型的说法正确的是( )
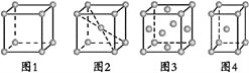
A.图1和图4为非密置层堆积,图2和图3为密置层堆积
B.图1~图4分别是简单立方堆积、体心立方堆积、面心立方堆积、体心立方堆积
C.图1~图4每个晶胞所含有原子数分别为1、2、2、4
D.图1~图4堆积方式的空间利用率分别为52%、68%、74%、74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com