
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在漂白液中:Ag+、K+、NO3-、SO32-
B.K+、Na+、Br-、AlO2-在溶液中能大量共存,通入过量的CO2后仍能大量共存
C.![]() =1012的溶液中,NH4+、Ca2+、Cl-、NO3-
=1012的溶液中,NH4+、Ca2+、Cl-、NO3-
D.由水电离的c(H+)=1×10-10mol/L的溶液中:K+、Na+、HCO3-、AlO2-
【答案】C
【解析】
A、漂白液中含有H+、Cl-、ClO-等,Cl-与Ag+会生成难溶物AgCl,H+和ClO- 均会与SO32-反应,故A不符合题意;
B、K+、Na+、Br-、AlO2-在溶液中不发生化学反应,能大量共存,通入CO2后会发生化学反应:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(少量CO2)、CO32-+CO2+H2O=2HCO3-(过量CO2),通入CO2后不能大量共存,故B不符合题意;
C、根据![]() =1012可知,该溶液呈酸性,这几种离子之间不反应且和氢离子也不反应,所以能大量共存,故C符合题意;
=1012可知,该溶液呈酸性,这几种离子之间不反应且和氢离子也不反应,所以能大量共存,故C符合题意;
D、常温下,由水电离的c(H+)=1×10-10mol/L的溶液可能呈酸性,也可能呈碱性,HCO3-与H+、OH-均会发生反应、AlO2-不能与H+大量共存,故D不符合题意。


科目:高中化学 来源: 题型:
【题目】下列叙述或书写正确的是
A. H2(g)+F2 (g)===2HF(g) △H=-270 kJ·mol -1,则相同条件下,2mol HF气体的能量大于1mol氢气和1mol氟气的能量之和
B. 2H2(g)+O2(g)===2H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热大于241.8kJ.mol-1
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该中和反应的热化学方程式为NaOH+HCl===NaCl+H2O △H =-57.4kJ·mol-1
D. 500℃、30MPa时,发生反应N2(g)+3H2(g) ![]() 2NH3(g) △H =-38.6kJ·mol-1在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
2NH3(g) △H =-38.6kJ·mol-1在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质分子式都是C7H8O,若滴入FeCl3溶液,只有C呈紫色;若投入金属钠,只有B没有变化。
(1)写出A、B的结构简式:A______________________,B________________。
(2)A、C都能与Na、NaOH反应吗?A、C都能与NaHCO3反应吗?若能反应,完成它们的化学方程式(若有同分异构体,只写出其中一种所发生反应的化学方程式即可) ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 溶液与
溶液与![]() 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题
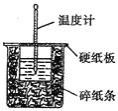
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是__________________。
(2)烧杯间填满碎纸条的作用是__________________。
(3)实验数据如下表:
温度 实验 次数 | 起始温度 | 终止温度 | 温度差平均值 | ||
| KOH | 平均值 | |||
1 |
|
|
|
| |
2 |
|
|
|
| |
3 |
|
|
|
| |
4 |
|
|
|
| |
![]() 本次实验的温度差的平均值
本次实验的温度差的平均值![]() _________
_________![]() 。
。
![]() 近似地认为
近似地认为![]() 溶液和
溶液和![]() 溶液的密度都是
溶液的密度都是![]() ,中和后生成溶液的比热容
,中和后生成溶液的比热容![]() ,则中和热
,则中和热![]() _________
_________![]() 数值精确到
数值精确到![]() 。
。
![]() 中和热测定实验中,下列操作一定会降低实验准确性的是_________。
中和热测定实验中,下列操作一定会降低实验准确性的是_________。
![]() 用滴定管
用滴定管![]() 精量仪器,读数保留到
精量仪器,读数保留到![]() 取所用酸碱溶液的体积
取所用酸碱溶液的体积
![]() 溶液在倒入小烧杯时,有少量溅出
溶液在倒入小烧杯时,有少量溅出
![]() 大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
![]() 测量
测量![]() 溶液的温度计用水洗净后才用来测KOH溶液的温度
溶液的温度计用水洗净后才用来测KOH溶液的温度
(4)实验中改用![]() 盐酸跟
盐酸跟![]() 溶液进行反应,与上述实验相比,所放出的热量_________
溶液进行反应,与上述实验相比,所放出的热量_________![]() 填“相等”或“不相等”
填“相等”或“不相等”![]() ,所求中和热_________
,所求中和热_________![]() 填“相等”或“不相等”
填“相等”或“不相等”![]() 。
。
(5)若用![]() 溶液进行上述实验,测得的中和热的数值会_________
溶液进行上述实验,测得的中和热的数值会_________![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有_________、___________。
Ⅱ.测定中和热的实验装置如下图所示。
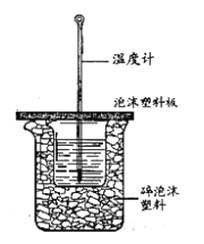
(3)大小烧杯之间填满碎泡沫塑料的作用是________,从实验装置上看,图中缺少的一种玻璃仪器________。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____℃ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②通过计算可得中和热△H=___________(精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是____。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_________(填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院在斯德哥尔摩宣布2019年度诺贝尔化学奖授予在锂离子电池的发展方面做出贡献的科学家。锂电池作为最主要的便携式能量源,影响着我们生活的方方面面。锂空气电池放电的工作原理如图所示。下列叙述正确的是( )
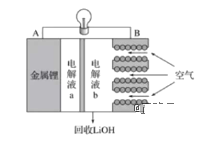
A.电池放电时负极电极方程式为O2+2H2O+4e-=4OH-
B.放电时电子由B极向A极移动
C.电解液a,b之间可采用阴离子交换膜
D.电解液b可能为稀LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是
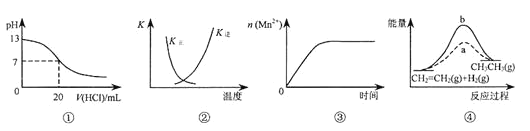
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是研制某种治疗白血病的新药所需的一种重要中间体,可有下列路线合成:
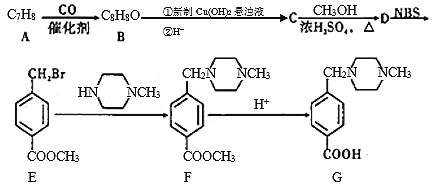
请根据上述合成信息回答下列有关问题:
(1)![]() 的结构简式为: ______
的结构简式为: ______
(2)E中所含官能团的名称是: ______ ,![]() 反应类型是: ______
反应类型是: ______
(3)可满足下列条件D的同分异构体共有______种,其中的![]() 种物质的结构简式是:______
种物质的结构简式是:______
![]() 二取代苯
二取代苯![]() 含有醛基
含有醛基![]() 能与
能与![]() 溶液发生显色反应
溶液发生显色反应
(4)完成下列反应方程式:
![]() 与足量的NaOH水溶液共热 ______
与足量的NaOH水溶液共热 ______
![]() 先在强碱溶液中充分水解后再酸化,利用所得产物合成高聚物的化学方程式为 ______
先在强碱溶液中充分水解后再酸化,利用所得产物合成高聚物的化学方程式为 ______
(5)![]() 结构简式为
结构简式为![]() ,则关于NBS与D反应生成E的说法错误的是 (_____)
,则关于NBS与D反应生成E的说法错误的是 (_____)
![]() 该反应是加成反应
该反应是加成反应
![]() 的核磁共振氢谱中有一组吸收峰
的核磁共振氢谱中有一组吸收峰
![]() 加入适当的溶剂可以加快该反应的速率
加入适当的溶剂可以加快该反应的速率
![]() 与液溴反应也能转化为纯净的E,只是会造成污染
与液溴反应也能转化为纯净的E,只是会造成污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com