
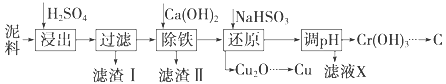
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下图:
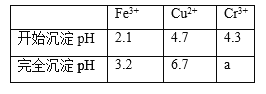
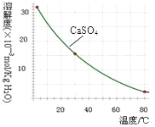
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到__;②将浊液加热到80℃,______.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式___________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是________.
(4)当离子浓度≤1×10﹣5 molL﹣1认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH﹣)≥_______.已知:Ksp[Cr(OH)3]=6.3×10﹣31,![]() ≈4.0)
≈4.0)
【答案】CuSO4 3.2 趁热过滤 2H2O+HSO3﹣+2Cu2+=Cu2O↓+SO42﹣+5H+ 产生SO2污染环境 4.0×10﹣9 molL﹣1
【解析】
(1)根据氧化铜和硫酸反应生成硫酸铜和水进行分析;
(2)由图表可知铁离子完全沉淀pH为3.2,Cr3+开始沉淀pH为4.3,因此在除铁的操作中需要除去Fe3+和CaSO4,而CaSO4溶解度随温度的升高而减小,易于除去;
(3)HSO3-具有较强的还原性,能和Cu2+之间发生反应生成SO42-和Cu2O,过量的HSO3-和酸反应生成SO2和水,;
(4)根据Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)进行计算。
(1)氧化铜和硫酸反应生成硫酸铜和水,所以浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有CuSO4;
(2)由图表可知铁离子完全沉淀pH为3.2,Cr3+开始沉淀pH为4.3,因此在除铁的操作中需要除去Fe3+和CaSO4,操作过程为:①加入石灰乳调节pH=3.2;②将浊液加热到80℃,趁热过滤;
(3)HSO3-具有较强的还原性,能和Cu2+之间发生反应生成SO42-和Cu2O,反应为:2H2O+HSO3-+2Cu2+= Cu2O↓+SO42-+5H+,在酸性环境下,HSO3-和H+反应成成的SO2有毒,能污染环境;
(4)当离子浓度≤1×10﹣5 molL﹣1认为沉淀完全,若要使Cr3+完全沉淀,需要让c(OH-)≥ =
=![]() =4.0×10-9mol/L。
=4.0×10-9mol/L。


科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )

A. BaCl2,CaCO3一定存在,NaOH可能存在
B. K2SO4、CuSO4一定不存在
C. K2SO4、NaOH、CaCO3、BaCl2一定存在,CuSO4可能存在
D. C为单一溶质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A.蔗糖中滴入浓硫酸,搅拌变黑;C12H22O11+H2O![]() 2C6H12O6(葡萄糖)
2C6H12O6(葡萄糖)
B.湿润的KI淀粉试纸遇Cl2变蓝:2KI+Cl2=2KCl+I2
C.乙烯通入Br2的CCl4溶液中,橙红色褪去;CH2=CH2+Br2![]()
![]()
D.铜丝在酒精灯上灼烧变黑后立刻插入乙醇后又变为光亮的紫红色:2Cu+O2![]() 2CuO,CH3CH2OH +CuO
2CuO,CH3CH2OH +CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质可溶于水、乙醇,熔点为209.5℃,其结构简式如图所示。下列说法正确的是( )
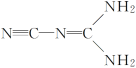
A.该物质为原子晶体
B.该物质分子中σ键和π键的个数比为5∶3
C.该物质分子中每个原子最外层均达到8电子稳定结构
D.该物质分子中含有极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如图所示。甲与戊的原子序数相差3,戊是空气中含量最多的元素,丁与辛是同周期元素。下列说法正确的是( )
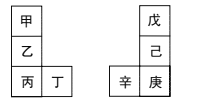
A.丙不能与水发生反应
B.己和氯气反应的产物只有一种
C.丙与庚的原子核外电子数相差13
D.乙形成的氧化膜疏松,不能保护内层金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的组成,对其进行探究。
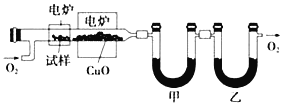
实验步骤如下:
![]() 按上述装置图连接好各仪器,检验装置的气密性。
按上述装置图连接好各仪器,检验装置的气密性。
![]() 向装置中通入氧气,一段时间后,启动电炉达到一定温度,有机物X经气化后缓慢通过灼热的氧化铜,与氧气充分反应。
向装置中通入氧气,一段时间后,启动电炉达到一定温度,有机物X经气化后缓慢通过灼热的氧化铜,与氧气充分反应。
![]() 生成的气体依次通过甲、乙两个U形管被完全吸收。
生成的气体依次通过甲、乙两个U形管被完全吸收。
![]() 关闭电炉,一段时间后停止通入氧气。测得甲、乙两个U形管增重分别为
关闭电炉,一段时间后停止通入氧气。测得甲、乙两个U形管增重分别为![]() 和
和![]() 。
。
![]() 通过仪器分析测得X的相对分子质量为106。
通过仪器分析测得X的相对分子质量为106。
回答下列问题:
![]() 的分子式为______。
的分子式为______。
![]() 甲中的试剂为
甲中的试剂为![]() 写化学式
写化学式![]() ______,某同学认为该套装置不合理,其理由是______。
______,某同学认为该套装置不合理,其理由是______。
![]() 写出符合下列条件的所有X的结构简式______。
写出符合下列条件的所有X的结构简式______。
![]() 芳香烃
芳香烃![]() 苯环上的一氯代物有三种
苯环上的一氯代物有三种
![]() 以醋酸为溶剂在催化剂作用下用氧气氧化X的某一同分异构体得到另一种重要的化工原料PTA,查阅资料得知PTA的溶解度:
以醋酸为溶剂在催化剂作用下用氧气氧化X的某一同分异构体得到另一种重要的化工原料PTA,查阅资料得知PTA的溶解度:![]() 时
时![]() 、
、![]() 时
时![]() 、
、![]() 时
时![]() 。得到的粗产品中有部分不溶性杂质,提纯PTA粗品的实验步骤为:将PTA粗品溶于适量热水、______、______、过滤、洗涤、干燥。
。得到的粗产品中有部分不溶性杂质,提纯PTA粗品的实验步骤为:将PTA粗品溶于适量热水、______、______、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.已知2C(s)+2O2(g)=2CO2(g)△H=a kJmol-1,2C(s)+O2(g)=2CO(g)△H=b kJmol-1,则a>b
B.石墨和金刚石完全燃烧的化学方程式均可表示为“C+O2![]() CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3,放热19.3 kJ,据此实验事实可知:该条件下,每生成1mol NH3,放热19.3 kJ
D.4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g)是放热反应,Cl-Cl键和O=O键的键能分别243kJmol-1和498kkJmol-1,则可推算出H-O键的键能比H-Cl键的键能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中![]() 与
与![]() 关系如图所示。下列说法不正确的是
关系如图所示。下列说法不正确的是![]()
![]()
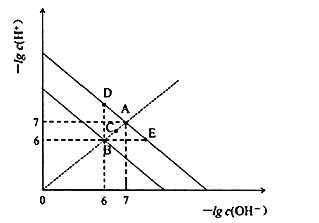
A.图中五点![]() 间的关系:
间的关系:![]()
B.![]() 点对应的水溶液中,可能有
点对应的水溶液中,可能有![]() 、
、![]() 、
、![]() 、
、![]() 大量同时存在
大量同时存在
C.若![]() 的NaHA溶液水溶液中
的NaHA溶液水溶液中![]() 与
与![]() 关系如图D点所示,则溶液中有:
关系如图D点所示,则溶液中有:![]()
D.向![]() 溶液中滴入
溶液中滴入![]() 溶液,当
溶液,当![]() 与
与![]() 关系如图E点所示,则溶液中反应:
关系如图E点所示,则溶液中反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法不正确的是(NA为阿伏加德罗常数的值)
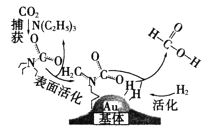
A.10.1gN(C2H5)3中所含的共价键数目为2.1NA
B.标准状况下,22.4LCO2中所含的电子数目为16NA
C.在捕获过程中,二氧化碳分子中的共价键完全断裂
D.100g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com