
【题目】下列说法中正确的是
A.已知2C(s)+2O2(g)=2CO2(g)△H=a kJmol-1,2C(s)+O2(g)=2CO(g)△H=b kJmol-1,则a>b
B.石墨和金刚石完全燃烧的化学方程式均可表示为“C+O2![]() CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
CO2”,故相同条件下,12g的石墨和金刚石充分燃烧放出的热量相等
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3,放热19.3 kJ,据此实验事实可知:该条件下,每生成1mol NH3,放热19.3 kJ
D.4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g)是放热反应,Cl-Cl键和O=O键的键能分别243kJmol-1和498kkJmol-1,则可推算出H-O键的键能比H-Cl键的键能大
【答案】D
【解析】
A.物质完全燃烧放出的热量多于不完全燃烧;
B.石墨和金刚石是两种结构和性质不同的物质,具有的能量不同;
C.合成氨的反应为可逆反应;
D.放热反应△H=反应物的总键能-生成物的总键能<0。
A.物质完全燃烧放出的热量多于不完全燃烧,因而C生成CO2比生成CO放出的热量多,放热△H<0,则有a<b,A项错误;
B.石墨和金刚石是两种结构和性质不同的物质,具有的能量不同,完全燃烧放出热量不同,B项错误;
C.合成氨的反应为可逆反应,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3,放热19.3 kJ,那么每生成1mol NH3,放热大于19.3 kJ,C项错误;
D.放热反应△H=反应物的总键能-生成物的总键能<0,则有4E(H-Cl)+E(O=O)-2E(Cl-Cl)-4E(H-O)<0,即4E(H-Cl)+498-2×243-4E(H-O)<0,E(H-Cl)- E(H-O)<3,E(H-Cl) <3+ E(H-O),可推算出H-O键的键能比H-Cl键的键能大,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞的结构如图所示。X(●)位于立方体顶点,Y(○)位于立方体中心。试
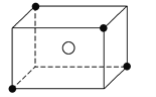
(1)晶体中每个Y同时吸引着__个X,每个X同时吸引着__个Y,该晶体的化学式为____________。
(2)晶体中每个X周围与它最接近且距离相等的X共有___个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是____。
(4)设该晶体的摩尔质量为Mg·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质或数据与氢键无关的是( )
A.氨极易溶于水
B.邻羟基苯甲酸(![]() )的熔点为159℃,对羟基苯甲酸(
)的熔点为159℃,对羟基苯甲酸(![]() )的熔点为213℃
)的熔点为213℃
C.冰的密度比水小
D.HF分解时吸收的热量比HCl分解时吸收的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
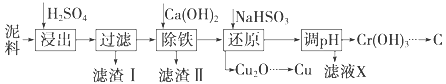
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下图:
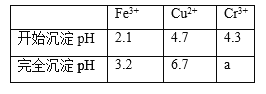
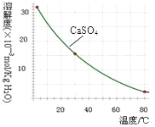
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到__;②将浊液加热到80℃,______.
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式___________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是________.
(4)当离子浓度≤1×10﹣5 molL﹣1认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH﹣)≥_______.已知:Ksp[Cr(OH)3]=6.3×10﹣31,![]() ≈4.0)
≈4.0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间的转化均能实现的是
A.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
B.CuCl2(aq) ![]()
C.MgCl2﹒6H2O(s) ![]()
D.CH3CH2CH2CH2Br![]() CH3CH2CH=CH2
CH3CH2CH=CH2![]()
![]()
![]() CH2=CH-CH=CH2
CH2=CH-CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是
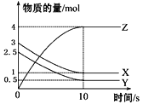
A.反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应开始到10 s,用Z表示的反应速率为0.3 mol·L-1·s-1
C.10 s后,该反应停止进行
D.反应开始到10 s时,反应速率:υ(X)=υ(Y)=0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,0.200 molL-1的HA溶液与0.200 molL-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒 | X | Y | Na+ | A- |
浓度/(mol·L-1) | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol·L-1HA溶液的pH=1 B. 该温度下Kw=1.0![]() 10-14
10-14
C. 微粒X表示OH-,Y表示H+ D. 混合溶液中:n(A-)+n(X)=n(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠![]() 用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成
用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都具有漂白作用.已知
都具有漂白作用.已知![]() ,经测定
,经测定![]() 时各组分含量随pOH变化情况如图所示
时各组分含量随pOH变化情况如图所示![]() 没有画出
没有画出![]() ,此温度下,下列分析正确的是
,此温度下,下列分析正确的是![]()
![]()
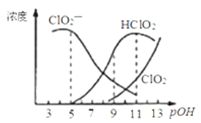
A.![]() 的电离平衡常数的数值
的电离平衡常数的数值![]()
B.亚氯酸钠在酸性条件下较稳定
C.![]() 时,溶液中含氯微粒的浓度大小为:
时,溶液中含氯微粒的浓度大小为:![]()
D.同浓度的![]() 溶液和
溶液和![]() 溶液等体积混合,则混合溶液中有
溶液等体积混合,则混合溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的一元酸HA,溶液的pH的变化曲线如图所示, 不正确的是
的一元酸HA,溶液的pH的变化曲线如图所示, 不正确的是
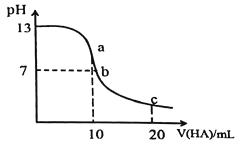
A.a点时,溶液中存在![]()
B.b点时,![]()
C.c点时,溶液中存在![]()
D.水的电离程度:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com