
【题目】根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。图示装置和原理不合理的是
A.制取氨气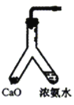 B.制取NaHCO3
B.制取NaHCO3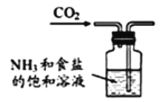
C.分离NaHCO3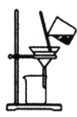 D.干燥NaHCO3
D.干燥NaHCO3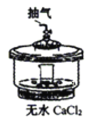
科目:高中化学 来源: 题型:
【题目】钾玻璃中含有18.4%的K2O,11.0%的CaO,70.6%的SiO2。
(1)计算三种氧化物的物质的量之比_________。
(2)若需制造5.1 t 钾玻璃,需用碳酸钾、石灰石、石英各_________吨?
(3)生产过程中释放出_________吨温室气体二氧化碳?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知普通玻璃的成分为Na2O∶13%,CaO∶11.7%,SiO2∶75.3%。某玻璃厂现有石灰石500 t,纯碱2 400 t。计算上述原料能生产普通玻璃_________吨?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铁[Fe2(OH)nCl6-n]m简称PFC,是一种新型高效的无机高分子净水剂。以FeCl2·4H2O为原料,溶于稀盐酸并加入少量的NaNO2,经氧化、水解、聚合等步骤,可制备PFC。
(1)在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化原理如图所示。 M的化学式为______; Fe2+在酸性条件下被O2氧化的离子方程式为_______。

(2)盐基度[B=![]() × 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
× 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
(3)PFC样品中盐基度(B)的测定:
已知:PFC样品的密度ρ = 1.40 g·mL1,样品中铁的质量分数ω(Fe) = 16%
步骤1:准确量取1.00 mL PFC样品置于锥形瓶中。
步骤2:加入一定体积0.05000 mol·L1的盐酸标准溶液,室温静置后,加入一定体积的氟化钾溶液(与Fe3+反应,消除Fe3+对实验的干扰),滴加数滴酚酞作指示剂,立即用0.05000 mol·L1氢氧化钠标准溶液滴定至终点,消耗氢氧化钠标准溶液13.00 mL。
步骤3:准确量取1.00 mL蒸馏水样品置于锥形瓶中,重复步骤2操作,消耗氢氧化钠标准溶液49.00 mL。
根据以上实验数据计算PFC样品的盐基度(B)(写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,一容积不变的密闭容器里充满硫化氢和氧气的混合气体,点燃恰好完全反应后,恢复至原状态,压强变为原来的![]() ,计算原混合气体的硫化氢和氧气的体积比________。
,计算原混合气体的硫化氢和氧气的体积比________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数和温度的关系如下:
C(g)+D(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
现有两个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molA和1molB,在Ⅱ中充入1molC和1 molD,800℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中的压强相等B.容器Ⅰ、Ⅱ中反应的平衡常数相同
C.容器Ⅰ中C的体积分数比容器Ⅱ中的小D.容器Ⅰ中A的浓度比容器Ⅱ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
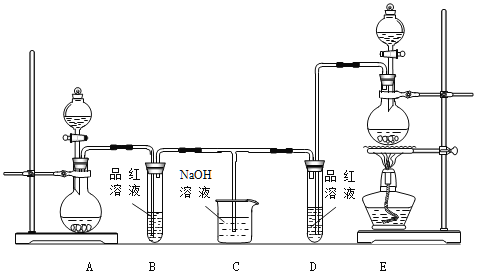
(1)他们制备Cl2依据的原理是:MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 。
(3)NaOH溶液分别与两种气体反应的离子方程式是 、 。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,科学家新研制的一种酸性乙醇电池(用磺酸类质子作溶剂),比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=== 2CO2+3H2O,电池构造如下图所示:
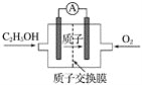
下列关于该电池的说法不正确的是( )
A. 通入乙醇的一极为负极
B. 正极反应式为4H++O2+4e-===2H2O
C. 负极反应式为C2H5OH-12e-+3H2O===2CO2+12H+
D. 随着反应的进行,溶液的酸性保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)既能消毒杀菌,又能净水,是一种理想的水处理剂。工业 上制备高铁酸钾的一种工艺流程如下:
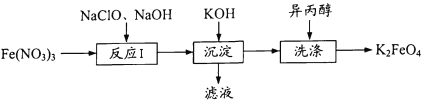
(1)K2FeO4中铁元素的化合价为 ____。
(2) “反应I”中参加反应的Fe3+与ClO-的物质的量之比为2 : 3,则滤液中含氯物质的化学式为____。写出“反应I”的离子方程式:_____。
(3)K2FeO4在水中发生反应:4K2FeO4+ 10H2O = 4Fe(OH)3 (胶体)+8KOH+3O2 ↑。高铁酸钾能消毒杀菌是因为____;它能净水是因为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com