
【题目】CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义.利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为: ①CH4(g)═C(s)+2H2(g)△H=75.0kJmol﹣1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=41.0kJmol﹣1
③CO(g)+H2(g)═C(s)+H2O(g)△H=﹣131.0kJmol﹣1
(1)反应CO2(g)+CH4(g)═2CO(g)+2H2(g)的△H= .
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图1. 
①同温度下CO2的平衡转化率(填“大于”或“小于”)于CH4的平衡转化率,其原因是 .
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是 .
(3)一定条件下Pd﹣Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图2所示,该反应的化学方程式为 , 反应过程中碳元素的化合价为﹣2价的中间体是 . 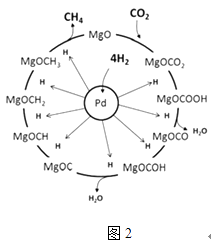
(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4+Na2CO3═CaCO3+Na2SO4 , 则达到平衡后,溶液中 ![]() = . [用Ksp(CaSO4)和Ksp(CaCO3)表示].
= . [用Ksp(CaSO4)和Ksp(CaCO3)表示].
【答案】
(1)+247kJ?mol﹣1
(2)大于;CO2发生了其他副反应;该反应△H>0,△S>0,高温时△G=△H﹣T△S<0
(3)CO2+4H2═CH4+2H2O;MgOCH2
(4)![]()
【解析】解:(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol③CO(g)+H2(g)═C(s)+H2O(g)△H=﹣131.0kJ/mol反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②﹣③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,所以答案是:+247kJ/mol;(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;所以答案是:大于;CO2发生了其他副反应;②反应自发进行的判据:△H﹣T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,所以答案是:该反应△H>0,△S>0,高温时△G=△H﹣T△S<0;(3)据信息:一定条件下Pd﹣Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2=CH4+2H2O;反应过程中碳元素的化合价为﹣2价的中间体是MgOCH2;所以答案是:CO2+4H2=CH4+2H2O;MgOCH2;(4)达到平衡后,Ksp(CaCO3)=c(Ca2+)c(CO32﹣),Ksp(CaSO4)=c(Ca2+)c(SO42﹣),在 ![]() 分子和分母同乘以钙离子的浓度,所以溶液中
分子和分母同乘以钙离子的浓度,所以溶液中 ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() .
.
【考点精析】本题主要考查了反应热和焓变和化学平衡的计算的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A. 乙烯使溴的四氯化碳溶液褪色B. 乙醇使酸性高锰酸钾溶液褪色
C. 乙烷与氯气在光照条件下反应D. 苯与氢气反应生成环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2OHCOO﹣+H3O+
B.CO2+H2OHCO3﹣+H+
C.CO32﹣+H2OHCO3﹣+OH﹣
D.HS﹣+H2OS2﹣+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各组物质:①NaNO3和NaCl;②CaCl2和CaCO3;③MnO2和KC1;④BaSO4和AgCl。可按照溶解、过滤、蒸发的实验操作顺序,将它们相互分离的是
A. 只有① B. ③④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 0.18 mol·L-1 D. 0.24 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如下图所示装置进行有关实验。

(1)此装置中,怎样检查除启普发生器之外的装置的气密性?_________________________________。
(2)请完成该实验的有关操作步骤。
①检查装置气密性;
②打开a、b产生氢气,观察试管内物质的颜色变化;
③____________________________________________________;
④加热过氧化钠,观察试管内物质的颜色变化;
⑤反应完全后,__________________________________________;
⑥拆卸装置。
(3)该装置中,碱石灰的作用是_________________________ 。
(4)实验过程中观察到(2)中步骤②无明显变化,步骤④Na2O2熔化后,黄色粉末立即变成白色,干燥管内硫酸铜未变成蓝色。则Na2O2与H2反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某无色溶液只含有Na+、Ba2+、Al3+、Fe3+、Br-、SO42-、CO32-中两种或多种离子,取少量逐滴滴入NaOH溶液至过量,先出现白色沉淀后消失的现象;另取少量往其中滴加氯水,溶液为橙黄色;则原溶液一定不存在__________(填离子符号)。写出原溶液加入过量的NaOH溶液反应的离子方程式_______________。
(2)KClO3和浓盐酸在一定温度下的化学方程式为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。浓盐酸在反应中表现出来的性质是__________(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性。
反应中,若氧化产物比还原产物多0.1mol,则电子转移的物质的量为__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com