
【题目】拟用下图所示装置制取并收集下表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂)能达到实验目的的是( )
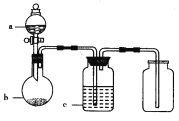
选项 | 气体 | a | b | c |
A | H2 | 稀硫酸 | 锌 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | 饱和NaCl溶液 |
C | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
D | NO | 稀硝酸 | 铜 | 浓硫酸 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】屠呦呦受“青蒿一握,以水二斤渍,绞取汁”启发,改用乙醚从青蒿中提取出抗疟疾药物青蒿素。青蒿素的提取过程不包含的操作是
A. 过滤B. 灼烧C. 蒸馏D. 萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的二氧化锰与40 mL 10 mol/L浓盐酸反应产生的氯气同0.1 mol二氧化锰与足量的浓盐酸反应产生的氯气相比( )
A. 前者产生的Cl2多 B. 后者产生的Cl2多
C. 一样多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(1)真空碳热还原﹣氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)═6AlCl(g)+6CO(g)△H=akJmol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJmol﹣1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=kJmol﹣1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)= , T1℃时,该反应的平衡常数K=;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的NO
b.加入一定量的活性炭
c.加入合适的催化剂
d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q0(填“>”或“<”).
④在绝热恒容条件下,能判断该反应一定达到化学平衡状态的依据是(填选项编号).
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在相应的条件下可能大量共存的是( )
A.能使pH试纸变红的溶液中:CO32﹣、K+、Cl﹣、Na+
B.由水电离产生的c(OH﹣)=1×10﹣10 mol?L﹣1的溶液中:NO3﹣、Mg2+、Na+、SO42﹣
C.在 ![]() =1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
=1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
D.![]() =10﹣10 mol?L﹣1的溶液中:Na+、HCO3﹣、Cl﹣、K+
=10﹣10 mol?L﹣1的溶液中:Na+、HCO3﹣、Cl﹣、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CaCO3(s)═CaO+CO2(g)△H=+177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=﹣131.3kJmol﹣1
③ ![]() H2SO4(1)+NaOH(1)═
H2SO4(1)+NaOH(1)═ ![]() Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
⑤CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283kJmol﹣1
O2(g)═CO2(g)△H=﹣283kJmol﹣1
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1)△H=﹣57.3kJmol﹣1
⑦2H2(g)+O2(g)═2H2O(1)△H=﹣517.6kJmol﹣1
(1)上述热化学方程式中,不正确的有 , 不正确的理由分别是
(2)根据上述信息,写出C转化为CO的热化学方程式: .
(3)上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E五种物质均含有同一元素,且A为单质,有如图所示的转化关系.则下列判断不正确的是( )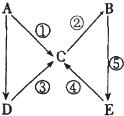
A.若ABCDE中同一元素的价态均不相同,则A为气态单质
B.若A为金属钠,则由1molD完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可以是氧化还原反应又可以是复分解反应
D.若A为金属铁,则化合物C和D均可以由化合反应生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从干海带中提取碘的操作过程中,仪器选用错误的是
A. 灼烧干海带﹣﹣坩埚
B. 过滤海带灰悬浊液﹣﹣长颈漏斗
C. 从碘水中萃取碘﹣﹣分液漏斗
D. 分离碘和四氯化碳﹣﹣蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中发生某化学反应2A(g)B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B,C的起始浓度都为0,反应物A的浓度(molL﹣1)随时间(min)的变化如图所示,请回答: 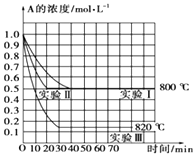
(1)在实验Ⅰ中,反应在0至40min内A的平均反应速率为molL﹣1min﹣1 .
(2)实验Ⅱ和实验Ⅰ的比较,可能隐含的反应条件是
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应升高温度,平衡向(填“正”或“逆”)反应方向移动,该正反应是(填“放热”或“吸热”)反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com