
实验测得CO和O2的混合气体的密度是相同状况下氢气密度的14.5倍.试求该混合气体中CO的质量分数.
科目:高中化学 来源: 题型:
 计算:
计算:查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省湛江二中高二第一次月考理科综合化学试卷(带解析) 题型:填空题
(共16分,没空2分)
已知下列热化学方程式:
①C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1
②H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l) ΔH=-57.3 kJ·mol-1
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
④CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1
⑤HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
⑥H2(g)+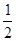 O2(g)===H2O(1) ΔH=-285.6kJ/mol
O2(g)===H2O(1) ΔH=-285.6kJ/mol
⑦C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) ΔH=-2220.0 kJ·mol-1
⑧ N2 (g)+ 3H2(g)="==" 2NH3 (g) ΔH=-92 kJ·mol-1
(1)上述热化学方程式中,不正确的有______________,不正确的理由分别是 _____________________________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式:______________________。
(3)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(4)已知:H2O(1)=H2O(g);ΔH=+44.0kJ/mol写出丙烷燃烧生成CO2和气态水的热化学方程式
(5)上述反应中,表示燃烧热的热化学方程式有__________________________________;
表示中和热的热化学方程式有______________。
(6) 已知H—H键能为436 kJ/mol,H—N键能为391kJ/mol,则N≡N键的键能是_____________?
查看答案和解析>>
科目:高中化学 来源:2014届广东省高二第一次月考理科综合化学试卷(解析版) 题型:填空题
(共16分,没空2分)
已知下列热化学方程式:
①C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1
②H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l) ΔH=-57.3 kJ·mol-1
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
④CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1
⑤HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
⑥H2(g)+ O2(g)===H2O(1)
ΔH=-285.6kJ/mol
O2(g)===H2O(1)
ΔH=-285.6kJ/mol
⑦C3H8(g)+5O2(g) ===3CO2(g)+4H2O(1) ΔH=-2220.0 kJ·mol-1
⑧ N2 (g)+ 3H2(g) === 2NH3 (g) ΔH=-92 kJ·mol-1
(1)上述热化学方程式中,不正确的有______________,不正确的理由分别是 _____________________________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式:______________________。
(3)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
(4)已知:H2O(1)=H2O(g);ΔH=+44.0kJ/mol写出丙烷燃烧生成CO2和气态水的热化学方程式
(5)上述反应中,表示燃烧热的热化学方程式有__________________________________;
表示中和热的热化学方程式有______________。
(6) 已知H—H键能为436 kJ/mol,H—N键能为391kJ/mol,则N≡N键的键能是_____________?
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年5月31日是第二十个世界无烟日,主题是“创建无烟环境”,烟草是造成人类死亡的第二大原因。中国人每年消费世界上1/3的香烟。吸烟有害健康,烟草不完全燃烧时产生的一氧化碳被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生下述反应:CO+Hb?O2 ![]() O2+Hb?CO,实验表明,Hb?CO的浓度即使只有Hb?02浓度的2%,也足以使人智力受损。当过多的血红蛋白与一氧化碳结合时,会引起窒息而死亡。
O2+Hb?CO,实验表明,Hb?CO的浓度即使只有Hb?02浓度的2%,也足以使人智力受损。当过多的血红蛋白与一氧化碳结合时,会引起窒息而死亡。
(1)化学平衡常数K表示可逆反应的进行程度,上述反应K= _________________ ,K值越大,表示_________________, K值大小与温度的关系是:温度升高,K值______________ (填“一定增大、一定减小、或可能增大也可能减小”)。
(2) Hb与CO通过什么化学键结合成Hb?CO分子的? 并判断Hb?CO分子与Hb?02分子的稳定性强弱
(3)抽烟后,吸入肺部的空气测得CO和02的浓度分别为10-6mol/L和10-2mol/L。已知37℃时,平衡常数K=220,这时Hb?CO的浓度是Hb?02浓度的________倍?这时候是否达到损伤人的智力的程度?试通过计算回答。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com