
����Ŀ��ʵ������������װ�ý���SO2���Ʊ�������ʵ��
����֪ϡ���ᡢ��������Ϊ������ʱ��һ���仹ԭ����Ϊһ��������
��lg2=0.3
��SO2������ˮ��ͨ���������ܽ�������Ϊ1��40

�ش��������⣺
��1������ȡSO2��Ӧ�Ļ�ѧ����ʽΪ_____________________________________________��
��ʵ�鿪ʼʱ�����5g CaCO3��������_____________________________________��
��2���ٵ�__________________ʱ����NaHSO3���嶶����ƿ�У��۲쵽Dƿ��Eƿ���ִ���������
��д��Dƿ�з�����Ӧ�����ӷ���ʽ_____________________________________��
�ۣ�1������2��������ӦA�еĵ����ܿڵ�λ����_____________��
A.ǰ��a����b�� B.ǰ��a����a�� C.ǰ��b����b�� D.ǰ��b����a��
��3��ʵ������B���Գ�������C�����л��ǣ�ͨ���ֳּ������B��C��Һ��pH�仯�õ�����ͼ��
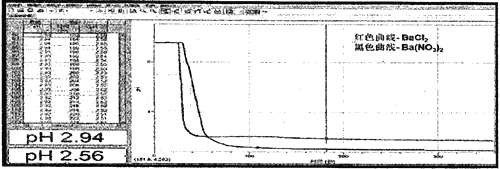
ͨ�����ۼ��㣬��C�����е�NO3-����ԭ��������Һ��ϡ10����pHΪ_______(��ȷС�����һλ)
��4�������������ʵ�鷽������SO2ͨ��BaCl2��Һ����ͨ��Ba(NO3)2��Һ��pH ����������NO3-�ܽ�SO2���������ۼ���ֵ��ʵ�ʲ��ֵ���ܴ�����ԭ����ͬ�����£�ϡHNO3��������_____ ϡ HNO2�������ԣ��ǿ�ڡ������ڡ��ӽ���������ʵ������ڰ�ȫ�������ȱ�ݣ����ڲ������Լ�ƿ��ǰ���¼��ԸĽ�_________________________��
���𰸡� NaHSO3+HC1= NaCl+SO2��+H2O ��ȡCO2����װ��ϵͳ�еĿ�������������е���������ʵ�� E�г��ְ�ɫ����ʱ SO2+2NO2-+Ba2+=BaSO4��+2NO C��D(ȫѡ��ѡһ��������) ��2NO3-+3SO2+2H2O+3Ba2+= 3BaSO4��+4H+ +2NO����õ���ҺpH= 0.7 ���� ��ÿ��ϴ��ƿ������װ�õ���ƿ��һ���ܣ�һ�˲�����Һ�У�һ����ͨ������ƽ����ѹ
�������������������1����NaHSO3��HC1��Ӧ�����Ȼ��ơ���������ˮ����CaCO3�����ᷴӦ���ɶ�����̼���壬����װ��ϵͳ�еĿ�������������е���������ʵ�飻��2����Ϊ��������е���������ʵ�飬��װ���г���������̼ʱ����NaHSO3���嶶����ƿ�У���Dƿ���ִ���������˵��D�ж�������������������ΪSO42-�������������ᱵ�������۵ڣ�1������Ӧ����ȡ�Ķ�����̼�ų�������������̼���ܶȴ��ڿ���������Ӧ��b���ų��������ڣ�2������Ӧ���Ʊ������������������������װ���У�����������ܶȴ��ڶ�����̼�����Դ�a�ڻ�b���ų���������3����������ͨ��C�з�Ӧ�����ӷ���ʽ��2NO3-+3SO2+2H2O+3Ba2+= 3BaSO4��+4H+ +2NO�����ݷ�Ӧ����ʽ����pH����4��ͬŨ�ȵ����ᱵ���Ȼ�����Һͨ���������C�����л��ǡ�Dƿ���ִ�����������ʵ���������������
��������1����NaHSO3��HC1��Ӧ�����Ȼ��ơ���������ˮ����Ӧ����ʽ��NaHSO3+HC1= NaCl+SO2��+H2O����CaCO3�����ᷴӦ���ɶ�����̼���壬����װ��ϵͳ�еĿ�������������е���������ʵ�飻��2����Ϊ��������е���������ʵ�飬��װ���г���������̼ʱ����NaHSO3���嶶����ƿ�У�װ���г���������̼ʱ��������E�г��ְ�ɫ��������Dƿ���ִ���������˵��D�ж�������������������ΪSO42-�������������ᱵ��������Ӧ���ӷ���ʽ��SO2+2NO2-+Ba2+=BaSO4��+2NO���۵ڣ�1������Ӧ����ȡ�Ķ�����̼�ų�������������̼���ܶȴ��ڿ���������Ӧ��b���ų��������ڣ�2������Ӧ���Ʊ������������������������װ���У�����������ܶȴ��ڶ�����̼�����Դ�a�ڻ�b���ų�������������Ӧ����ǰ��b����a����ǰ��b����b���� ��3����������ͨ��C�з�Ӧ�����ӷ���ʽ��2NO3-+3SO2+2H2O+3Ba2+= 3BaSO4��+4H+ +2NO��C��NO3-��Ũ����1mol/L�����ݷ�Ӧ����ʽ��C�����е�NO3-����ԭ����Һ��������Ũ����2 mol/L����Һ��ϡ10����������Ũ����0.2 mol/L,pH=![]() ����4��ͬŨ�ȵ����ᱵ���Ȼ�����Һͨ���������C�����л��ǡ�Dƿ���ִ���������˵��ϡHNO3������������ϡ HNO2�������ԣ���ʵ������������������ԸĽ���������ÿ��ϴ��ƿ������װ�õ���ƿ��һ���ܣ�һ�˲�����Һ�У�һ����ͨ������ƽ����ѹ��
����4��ͬŨ�ȵ����ᱵ���Ȼ�����Һͨ���������C�����л��ǡ�Dƿ���ִ���������˵��ϡHNO3������������ϡ HNO2�������ԣ���ʵ������������������ԸĽ���������ÿ��ϴ��ƿ������װ�õ���ƿ��һ���ܣ�һ�˲�����Һ�У�һ����ͨ������ƽ����ѹ��


 ������ϵ�д�
������ϵ�д� �żӾ���ϵ�д�
�żӾ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڼ�����������������������γ��¡��ʻ�����ͬʱʧȥһ���Ӵ����÷�Ӧ�ƿ���ɭ(R��L��Claisen)�����Ϸ�Ӧ���䷴Ӧ�������£�2RCH2COOC2H5![]()
 +C2H5OH������Claisen��Ӧ�Ʊ�������H��һ�ֺϳ�·�����£�
+C2H5OH������Claisen��Ӧ�Ʊ�������H��һ�ֺϳ�·�����£�

�ش��������⣺
��1��A������Ϊ__________��C�Ľṹ��ʽΪ__________��
��2��F�к��������ŵ�������__________;��Ӧ���ķ�Ӧ������__________��
��3��E��F��Ӧ�Ļ�ѧ����ʽΪ_________________________________��
��4��B�ĺ��б�����ͬ���칹����_____________��(B��������)�����к˴Ź���������ʾ3���Ľṹ��ʽΪ__________��__________��
��5��������������( ![]() )��һ����Ҫ���л��ϳ�ԭ�ϣ�д�����Ҵ��Ʊ��������������ĺϳ�·��(���Լ���ѡ)��______________
)��һ����Ҫ���л��ϳ�ԭ�ϣ�д�����Ҵ��Ʊ��������������ĺϳ�·��(���Լ���ѡ)��______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʾ�Ϊa g������������������ȫ�����IJ���ȫ��ͨ�뵽�����Ĺ������ƹ����У��������ƹ�������Ϊa g���������������������У� ��
��CO ��H2 ��CH4 ��HCHO ��CH3COOH ��HCOOH
A. 4 �� B. 5 �� C. 6�� D. 2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӧ�ü�Ϊ�㷺��������������ȡ����Ҫ�����������Σ�����Ҫ��ش��������
��1����������ᴿ����������Ҫ�ɷ���Al2O3(����Fe2O3��SiO2������)���ᴿ��������ͼ��ʾ��
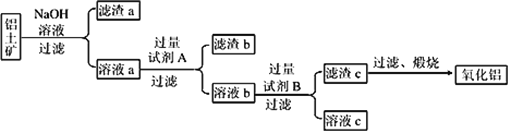
������NaOH��ҺĸҺ��������������顢ʪĥ����Ŀ����______________________________��
������Һa��ͨ�����CO2�����ò��������պ�Ҳ�ɵ�Al2O3���÷�����ȱ����___________________________________________________��
��2���Ʊ���ˮ�Ȼ���
�䷴ӦΪ��2Al2O3+6Cl2![]() 4AlCl3+O2
4AlCl3+O2
��Ϊ�ٽ��÷�Ӧ�Ľ��У�ʵ������������뽹̿����ԭ����_____________________________��
��3�������ȡ��
Ŀǰ�ɵ��µ��AlCl3���εõ�������������ˮ�Ȼ����۵�190�棬�е�180�棬�䵼������ͼ��
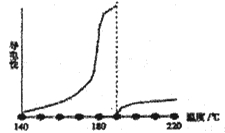
�ٴ�ͼ�п�֪��AlCl3����Һ��������___________________________��
�ڵ�����AlCl3�м���NaCl��ʹ�γɹ������AlCl3�Ƴ�������Һ�壬����������ǿ������Һ�д��ڵ���������Cl-��AlCl4-��Al2Cl7-����дAlCl3����NaCl���γ�������Һ����������ӷ���ʽ��AlCl3+ Cl-=AlCl4-����ƽ��________________________________��
�۵��ʱ��������Ҫ��AlCl4-�ŵ磬��缫��ӦΪ__________________________________��
��Ϊ��֤�����У�����Һ��Ҫ������AlCl4-��Al2Cl7-����n(AlCl3)��n(NaCl)Ӧ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��3��21���ǵڶ�ʮ��조����ˮ�ա�������ˮ��Դ���������÷�ˮ��ʡˮ��Դ����ǿ��ˮ�Ļ��������ѱ�Խ��Խ���������ע����֪��ij��ɫ��ˮ�п��ܺ���H+��NH4+��Fe3+��Al3+��Mg2+��Na+��NO3����CO32����SO42���еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100 mL������������ʵ�飬��������й�ͼ��������ʾ��
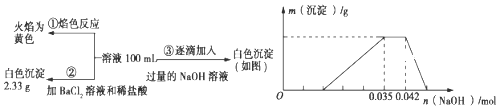
��ش��������⣺
��1����������3��ʵ����Է�����ˮ��һ�������ڵ���������_____��һ�����ڵ���������_____��
��2��д��ʵ���ͼ���г����ﵽ��������������ٷ����仯�η�����Ӧ�����ӷ�Ӧ����ʽ��_____��
��3������ͼ����ԭ��Һ��c��NH4+����c��Al3+���ı�ֵΪ_____�����ó��������������_____g��
��4����ͨ��ʵ��ȷ��ԭ��ˮ��c��Na+����0.14molL��1�����ж�ԭ��ˮ��NO3���Ƿ���ڣ�_____������ڡ��������ڡ���ȷ�������������ڣ�c��NO3������_____ molL��1�����������ڻ�ȷ����˿ղ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���Ӧ����ͬһ��Ӧ���͵���
A. ������һ�ȼ��顢����������
B. �����屽����ϩ���Ҵ�
C. �Ҵ�����ȩ���Ҵ�����������������
D. ���ƻ����顢��������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ݡ��м�����KNO3���ᴿ�������������������µ�����˪����ɨ��ˮ��֭���˼������ɡ�������δ�漰���IJ���������
A.����B.����C.�ᾧD.�ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������к�������[KAl(SO4)2]��Al2O3��Fe2O3����һ���������ɼ�ʵ����ͼ��ʾ������֮���ת����
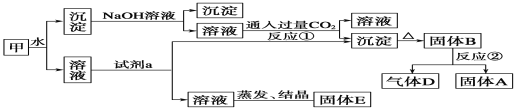
��ش��������⣺(1)д��A��B��D�Ļ�ѧʽ��A__________��B________��D__________��
(2)�Լ�a���ѡ��__________(ѡ��A��B��C��D)��
A��NaOH��Һ B��ϡ���� C��������̼ D����ˮ
(3)д����Ӧ�ڵĻ�ѧ����ʽ��___________________________________________��
����A��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ________________________________________
ͨ�����CO2��Ӧ�ٵ����ӷ���ʽ___________________________________________________
(4)����E������Ϊ�����ԵĻ�ѧ���ϣ�E���������ʵĻ�ѧʽΪ__________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com