
ЁОЬтФПЁПЖўТШбЧэП(SOCl2)ЪЧвЛжжЮоЩЋвзЛгЗЂвКЬхЃЌгіЫЎОчСвЫЎНтЩњГЩСНжжЦјЬхЃЌГЃгУзїЭбЫЎМСЃЌЦфШлЕу-105ЁцЃЌЗаЕу79ЁцЃЌ140ЁцвдЩЯЪБвзЗжНтЁЃ
ЃЈ1ЃЉгУСђЛЦЃЈгУSБэЪОЃЉЁЂвКТШКЭШ§бѕЛЏСђЮЊдСЯдквЛЖЈЬѕМўКЯГЩЖўТШбЧэПЃЌдзгРћгУТЪДя100%ЃЌдђШ§епЕФЮяжЪЕФСПБШЮЊ________ЁЃаДГіSOCl2ЮќЪеЫЎеєЦјЕФЛЏбЇЗНГЬЪНЃК____________ЁЃ
ЃЈ2ЃЉМзЭЌбЇЩшМЦЯТЭМзАжУгУZnCl2ЁЄxH2OОЇЬхжЦШЁЮоЫЎZnCl2ЃЌЛиЪеЪЃгрЕФSOCl2ВЂбщжЄЩњГЩЮяжаКЌгаSO2ЃЈМаГжМАМгШШзАжУТдЃЉЃК

ЂйзАжУЕФСЌНгЫГађЮЊAЁњBЁњ______Ёњ______Ёњ______Ёњ______ЁЃ
ЂкНСАшЕФзїгУЪЧ______ЃЌРфФ§ЙмЕФзїгУЪЧ______ЁЃ
ЂлЪЕбщНсЪјКѓЃЌЮЊМьВтZnCl2ЁЄxH2OОЇЬхЪЧЗёЭъШЋЭбЫЎЃЌГЦШЁеєИЩКѓЕФЙЬЬхagШмгкЫЎЃЌМгШызуСПЯЁЯѕЫсКЭЯѕЫсвјШмвКЃЌЙ§ТЫЃЌЯДЕгЃЌИЩдяЃЌГЦЕУЙЬЬхЮЊbgЁЃШє![]() _____ЃЈБЃСєвЛЮЛаЁЪ§ЃЉЃЌМДПЩжЄУїZnCl2ЁЄxH2OОЇЬхвбЭъШЋЭбЫЎЁЃ
_____ЃЈБЃСєвЛЮЛаЁЪ§ЃЉЃЌМДПЩжЄУїZnCl2ЁЄxH2OОЇЬхвбЭъШЋЭбЫЎЁЃ
ЂмввЭЌбЇШЯЮЊжБНгНЋZnCl2ЁЄxH2OОЇЬхжУгклсліжаМгШШМДПЩЕУЕНЮоЫЎZnCl2ЃЌЕЋРЯЪІЫЕДЫЗНЗЈВЛПЩЁЃЧыгУЛЏбЇЗНГЬЪННтЪЭдвђЃК____________ЁЃ
ЃЈ3ЃЉБћЭЌбЇШЯЮЊSOCl2ЛЙПЩгУзїгЩFeCl3ЁЄ6H2OжЦШЁЮоЫЎFeCl3ЕФЭбЫЎМСЃЌЕЋЖЁЭЌбЇШЯЮЊИУЪЕбщЛсЗЂЩњбѕЛЏЛЙдЗДгІЁЃЧыФуЩшМЦВЂМђЪіЪЕбщЗНАИХаЖЯЖЁЭЌбЇЕФЙлЕуЃК_____________ЁЃ
ЁОД№АИЁП 2:3:1 SOCl2+H2O=SO2Ёќ+2HClЁќ D E F C ЪЙZnCl2ЁЄxH2OОЇЬхОљдШЁЂГфЗжЕФгыSOCl2НгДЅЃЌОЇЬхЭбЫЎГфЗж АбЪЃгрЕФSOCl2 РфФ§ГЩвКЬхЛиЪе 2.1 ZnCl2ЁЄxH2O![]() Zn(OH) Cl+HClЁќ+(x-1) H2O
Zn(OH) Cl+HClЁќ+(x-1) H2O
ЛђZnCl2ЁЄxH2O![]() Zn(OH) 2+2HClЁќ+(x-2) H2OЁЂ(Zn(OH) Cl
Zn(OH) 2+2HClЁќ+(x-2) H2OЁЂ(Zn(OH) Cl![]() ZnO+HClЁќ)
ZnO+HClЁќ)
ЛђZnCl2ЁЄxH2O![]() ZnO+2HClЁќ+ (x-1) H2O ЗНЗЈ1ЃКШЁЩйСПFeCl3ЁЄ6H2OгкЪдЙмжаЃЌМгШыSOCl2ЃЌеёЕДЃЛдйЭљЪдЙмжаМгЫЎШмНтЃЌШЛКѓЕЮМгBaCl2ШмвКЃЌШєЩњГЩАзЩЋГСЕэдђжЄУїЭбЫЎЙ§ГЬЗЂЩњСЫбѕЛЏЛЙдЗДгІ
ZnO+2HClЁќ+ (x-1) H2O ЗНЗЈ1ЃКШЁЩйСПFeCl3ЁЄ6H2OгкЪдЙмжаЃЌМгШыSOCl2ЃЌеёЕДЃЛдйЭљЪдЙмжаМгЫЎШмНтЃЌШЛКѓЕЮМгBaCl2ШмвКЃЌШєЩњГЩАзЩЋГСЕэдђжЄУїЭбЫЎЙ§ГЬЗЂЩњСЫбѕЛЏЛЙдЗДгІ
ЗНЗЈ2ЃКШЁЩйСПFeCl3ЁЄ6H2OгкЪдЙмжаЃЌМгШыЙ§СПSOCl2ЃЌеёЕДЃЛдйЭљЪдЙмжаМгЫЎШмНтЃЌЕЮМгKSCNШмвКЃЌШєУЛгаУїЯдЯжЯѓдђжЄУїЭбЫЎЙ§ГЬЗЂЩњСЫбѕЛЏЛЙдЗДгІ
ЗНЗЈ3ЃКШЁЩйСПFeCl3ЁЄ6H2OгкЪдЙмжаЃЌМгШыЙ§СПSOCl2ЃЌеёЕДЃЛдйЭљЪдЙмжаМгЫЎШмНтЃЌЕЮМгK3[Fe(CN)6]ШмвКЃЌШєЩњГЩРЖЩЋГСЕэдђжЄУїЭбЫЎЙ§ГЬЗЂЩњСЫбѕЛЏЛЙдЗДгІ
ЁОНтЮіЁПЃЈ1ЃЉгУСђЛЦЃЈгУSБэЪОЃЉЁЂвКТШКЭШ§бѕЛЏСђЮЊдСЯдквЛЖЈЬѕМўКЯГЩЖўТШбЧэПЃЌдзгРћгУТЪДя100%ЃЌдђШ§епЗЂЩњСЫЛЏКЯЗДгІЃЌЛЏбЇЗНГЬЪНЮЊ2S+3Cl2+SO3=3SOCl2ЃЌЦфЮяжЪЕФСПБШЮЊ2:3:1ЁЃSOCl2ЮќЪеЫЎеєЦјЕФЛЏбЇЗНГЬЪНЮЊSOCl2+H2O=SO2Ёќ+2HClЁќ ЁЃ
ЃЈ2ЃЉгЩЬтвтжЊЃЌAЪЧОЇЬхЕФЭбЫЎЗДгІзАжУЃЛBЪЧЛиЪеЪЃгрЕФSOCl2ЕФзАжУЃЛCЪЧЮВЦјЮќЪезАжУЃЛDЪЧБЃЛЄзАжУЃЌЗРжЙЫЎеєЦјНјШыBжаЃЛEЪЧЗРжЙЕЙЮќЕФЃЛFЪЧгУгкМьбщЩњГЩЮяжаКЌгаSO2ЕФЁЃ
ЂйзАжУЕФСЌНгЫГађЮЊAЁњBЁњDЁњEЁњFЁњCЁЃ
ЂкНСАшЕФзїгУЪЧЪЙZnCl2ЁЄxH2OОЇЬхОљдШЁЂГфЗжЕФгыSOCl2НгДЅЃЌЪЙОЇЬхГфЗжЭбЫЎЃЌРфФ§ЙмЕФзїгУЪЧАбЪЃгрЕФSOCl2 РфФ§ГЩвКЬхЛиЪеЁЃ
ЂлЪЕбщНсЪјКѓЃЌЮЊМьВтZnCl2ЁЄxH2OОЇЬхЪЧЗёЭъШЋЭбЫЎЃЌГЦШЁеєИЩКѓЕФЙЬЬхZnCl2ЁЁagШмгкЫЎЃЌМгШызуСПЯЁЯѕЫсКЭЯѕЫсвјШмвКЃЌЙ§ТЫЃЌЯДЕгЃЌИЩдяЃЌГЦЕУЙЬЬхAgClЮЊbgЁЃШє![]() ЃЌМДПЩжЄУїZnCl2ЁЄxH2OОЇЬхвбЭъШЋЭбЫЎЁЃ
ЃЌМДПЩжЄУїZnCl2ЁЄxH2OОЇЬхвбЭъШЋЭбЫЎЁЃ
ЂмжБНгНЋZnCl2ЁЄxH2OОЇЬхжУгклсліжаМгШШЃЌОЇЬхЪзЯШЛсШмНтдкНсОЇЫЎжааЮГЩШмвКЃЌТШЛЏаПЗЂЩњЫЎНтЕУЕНМюЪНТШЛЏаПЛђЧтбѕЛЏаПЃЌЧтбѕЛЏаПЪмШШЗжНтЕУЕНбѕЛЏаПЃЌзмжЎЃЌЕУВЛЕНЮоЫЎZnCl2ЃЌЗЂЩњЕФЗДгІЕФЛЏбЇЗНГЬЪНЮЊZnCl2ЁЄxH2O![]() Zn(OH) Cl+HClЁќ+(x-1) H2O ЛђZnCl2ЁЄxH2O
Zn(OH) Cl+HClЁќ+(x-1) H2O ЛђZnCl2ЁЄxH2O![]() Zn(OH) 2+2HClЁќ+(x-2) H2OЁЂ(Zn(OH) Cl
Zn(OH) 2+2HClЁќ+(x-2) H2OЁЂ(Zn(OH) Cl![]() ZnO+HClЁќ)
ZnO+HClЁќ)
ЛђZnCl2ЁЄxH2O![]() ZnO+2HClЁќ+ (x-1) H2OЁЃ
ZnO+2HClЁќ+ (x-1) H2OЁЃ
ЃЈ3ЃЉSOCl2гыFeCl3ЁЄ6H2OШєЗЂЩњбѕЛЏЛЙдЗДгІЃЌдђ+3МлЬњНЋБЛЛЙдЮЊ+2МлЬњЃЌ+4МлSБЛбѕЛЏЮЊ+6МлSЃЌВњЮяжагабЧЬњРызгЁЂСђЫсИљЁЃвЊжЄУїЫќУЧШЗЪЕЗЂЩњСЫбѕЛЏЛЙдЗДгІЃЌЮвУЧПЩвдМьбщСђЫсИљЛђМьбщ+3МлЬњРызгЛђМьбщ+2МлбЧЬњРызгЃЌЫљвдПЩвдЩшМЦШчЯТ3ИіЪЕбщЗНАИЃКЗНЗЈ1ЃКШЁЩйСПFeCl3ЁЄ6H2OгкЪдЙмжаЃЌМгШыSOCl2ЃЌеёЕДЃЛдйЭљЪдЙмжаМгЫЎШмНтЃЌШЛКѓЕЮМгBaCl2ШмвКЃЌШєЩњГЩАзЩЋГСЕэдђжЄУїЭбЫЎЙ§ГЬЗЂЩњСЫбѕЛЏЛЙдЗДгІЁЃ
ЗНЗЈ2ЃКШЁЩйСПFeCl3ЁЄ6H2OгкЪдЙмжаЃЌМгШыЙ§СПSOCl2ЃЌеёЕДЃЛдйЭљЪдЙмжаМгЫЎШмНтЃЌЕЮМгKSCNШмвКЃЌШєУЛгаУїЯдЯжЯѓдђжЄУїЭбЫЎЙ§ГЬЗЂЩњСЫбѕЛЏЛЙдЗДгІЁЃ
ЗНЗЈ3ЃКШЁЩйСПFCl3ЁЄ6H2OгкЪдЙмжаЃЌМгШыЙ§СПSOCl2ЃЌеёЕДЃЛдйЭљЪдЙмжаМгЫЎШмНтЃЌЕЮМгK3[Fe(CN)6]ШмвКЃЌШєЩњГЩРЖЩЋГСЕэдђжЄУїЭбЫЎЙ§ГЬЗЂЩњСЫбѕЛЏЛЙдЗДгІЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаа№Ъіжае§ШЗЕФЪЧ
A. КЌгаРызгМќЕФЛЏКЯЮявЛЖЈЪЧРызгЛЏКЯЮя B. РызгЛЏКЯЮяжаВЛПЩФмКЌгаЙВМлМќ
C. КЌгаЙВМлМќЕФЛЏКЯЮявЛЖЈЪЧЙВМлЛЏКЯЮя D. ЙВМлЛЏКЯЮяжаПЩФмКЌгаРызгМќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАДвЊЧѓЬюПе
ЃЈ1ЃЉТШЫЎОпгаЖржжаджЪЃЌИљОнаТжЦТШЫЎЗжБ№гыШчЭМЮхжжЮяжЪЗЂЩњЕФЗДгІЬюПеЃЈТШЫЎзуСПЃЉЃК
аДГіЖдгІЕФЛЏбЇЗНГЬЪН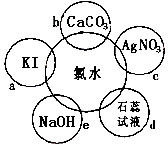
ЂйbЃЛ
ЂкcЃЛ
ЂлeЃЛ
ЃЈ2ЃЉФмжЄУїТШЫЎОпгаЦЏАзадЕФЯжЯѓЪЧЃЛ
ЃЈ3ЃЉОУжУЕФТШЫЎБфЮЊЃЈЬюГЩЗнЃЉЃЌгУЛЏбЇЗДгІЗНГЬЪНБэЪОЮЊ ЃЎ
ЃЈ4ЃЉЪЕбщЪвЛЙПЩгУИпУЬЫсМиПьЫйЕижЦШЁТШЦјЃЌЗДгІЕФЛЏбЇЗНГЬЪНШчЯТЃК
ЬюаДзжФИ2KMnO4+16HClЃЈХЈЃЉ=5Cl2Ёќ+2MnCl2+2KCl+8H2O
ЂйЧыгУЫЋЯпЧХБъГіИУЗДгІЕФЕчзгзЊвЦЗНЯђКЭЪ§ФП ЃЎ
ЂкИУЗДгІжаЕФбѕЛЏМСЪЧ ЃЌ ШєЯћКФ0.2molбѕЛЏМСЃЌдђБЛбѕЛЏЕФЛЙдМСЕФЮяжЪЕФСПЪЧ ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкКНЬьЗЩЛњЗЕЛиЕиЧђДѓЦјВуЪБЃЌЮЊЗРжЙЦфгыПеЦјОчСвФІВСЖјБЛЩеЛйЃЌашдкКНЬьЗЩЛњЭтБэУцАВзАБЃЛЄВуЁЃИУБЃЛЄВуЕФВФСЯПЩФмЮЊ
A. ТСКЯН№ B. КЯН№Иж C. аТаЭЬеДЩ D. ЫмСЯ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЩњЮяЬхзщГЩдЊЫиКЭЛЏКЯЮяЕФа№ЪіЃЌе§ШЗЕФЪЧ ЃЈ ЃЉ
AЃЎбЯжиШБЬњЕФШЫШнвзВњЩњШщЫсжаЖО
BЃЎЫЅРЯЯИАћжаЫЎЕФКЌСПБШНЯИпЃЌЯИАћДњаЛНЯТ§
CЃЎЕААзжЪКЭDNAЗжзгЕФЖрбљадЖМгыЫќУЧЕФПеМфНсЙЙУмЧаЯрЙи
DЃЎЕэЗлЁЂЬЧдЁЂЯЫЮЌЫиКЭТѓбПЬЧГЙЕзЫЎНтКѓЃЌЕУЕНЕФВњЮяЪЧВЛЭЌЕФ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊСЫМјБ№ФГАзЩЋЗФжЏЦЗЕФГЩЗжЪЧВЯЫП(ЕААзжЪ)ЛЙЪЧШЫдьЫП(КЯГЩЯЫЮЌ)ЃЌПЩбЁгУЕФЗНЗЈЪЧ
A. ЕЮМгОЦОЋ B. .зЦЩе C. ЕЮМгЪГбЮЫЎШмвК D. ЕЮМгЪГДз
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗНЗЈФмгУгкМјБ№БћЭЊ(CH3COCH3)КЭБћШЉЕФЪЧ
A.РюБШЯЃШМЩеЗЈB.ФЦШкЗЈC.ЭЫПШМЩеЗЈD.1H-NMRЦз
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгавЛАќТСШШМСЪЧТСЗлКЭбѕЛЏЬњЗлФЉЕФЛьКЯЮяЃЌдкИпЮТЯТЪЙжЎГфЗжЗДгІЃЌНЋЗДгІКѓЕФЙЬЬхЗжЮЊСНЕШЗнЃЌНјааШчЯТЪЕбщ(МЦЫуpHЪБМйЖЈШмвКЬхЛ§УЛгаБфЛЏ)ЃК
ЂйЯђЦфжавЛЗнЙЬЬхжаМгШы100 mL2.0 mol/LЕФNaOHШмвКЃЌМгШШЪЙЦфГфЗжЗДгІКѓЙ§ТЫЃЌВтЕУТЫвКЕФpH=14ЁЃ
ЂкЯђСэвЛЗнЙЬЬхжаМгШы140 mL 4.0 mol/LЕФHClШмвКЃЌЪЙЙЬЬхШЋВПШмНтЃЌВтЕУЗДгІКѓЫљЕУШмвКжажЛгаH+ЁЂFe2+КЭAl3+Ш§жжбєРызгЧвpH=0ЁЃ
ЃЈ1ЃЉаДГіИУТСШШЗДгІЕФЛЏбЇЗНГЬЪН_____________________________
ЃЈ2ЃЉетАќТСШШМСжаТСЗлЕФжЪСПЮЊ_________ , бѕЛЏЬњЗлФЉЕФжЪСП______________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЯТСаЪТЪЕЃК
Ђй Cr2O3ШмгкKOHШмвКЕУЕНKCrO2ШмвКЃЌCr2O3ШмгкСђЫсШмвКЕУЕНCr2(SO4)3ШмвКЃЛ
Ђк ЯђKCrO2ШмвКжаЕЮМгH2O2ШмвКЃЌдйЫсЛЏЃЌПЩЕУK2Cr2O7ШмвКЃЛ
Ђл НЋK2Cr2O7ШмвКЕЮМгЕНЕэЗл-KIШмвКжаЃЌШмвКБфРЖЁЃЯТСаа№ЪіВЛе§ШЗЕФЪЧ
A. ЪЕбщЂйжЄУїCr2O3ЪЧСНадбѕЛЏЮя
B. ЪЕбщЂкжаH2O2ЪЧбѕЛЏМСЃЌK2Cr2O7ЪЧбѕЛЏВњЮя
C. ЪЕбщЂлжЄУїбѕЛЏадЃКCr2O72->I-
D. ЪЕбщЂлжаЃЌШєЩњГЩ1.27gI2ЃЌдђЗДгІжазЊвЦ0.01molЕчзг
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com