
����Ŀ��X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ��������������X��Zͬ���壬���γ����ӻ�����ZX��Y��Mͬ���壬���γ�MY2��MY3���ַ��ӡ��ش��������⣺
��1�� Y��Ԫ�����ڱ��е�λ��Ϊ_____________________________.
��2�� ����Ԫ�ص�����������Ӧ��ˮ����������ǿ����_____________________ (д��ѧʽ)���ǽ�����̬�⻯�ﻹԭ����ǿ����_________________(д��ѧʽ)��
��3�� Y��G�ĵ��ʻ���Ԫ��֮���γɵĻ��������ˮ����������__________________ (д�������������ʵĻ�ѧʽ))��
��4�� ZX�ĵ���ʽΪ_________________��ZX��ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪ_____________��
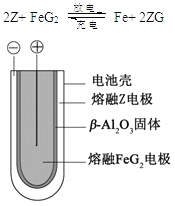
��5�� ����״̬�£�Z�ĵ��ʺ�FeG2����ɿɳ����(װ��ʾ��ͼ����)���ŵ�ʱ����ص�������Ӧ
���𰸡���1��Y��2����VIA
��2��HclO4��H2S
��3��O3��Cl2��ClO2��ȡ����������ֶ��ɣ�
��4��![]() ��
��![]()
��5��![]()
�����������������X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ������������������X��HԪ�أ�X��Zͬ���壬���γ����ӻ�����ZX����Yԭ����������Yԭ������������Z��NaԪ�أ�Y��Mͬ���壬���γ�MY2��MY3���ַ��ӣ�����Y��OԪ�أ�M��SԪ�أ�G�Ƕ���������Ԫ�أ�����G��ClԪ�أ�������ϡ�����壩��
��1��Y��OԪ�أ�Oԭ����2�����Ӳ㣬����������Ϊ6�����ڵڶ����ڵ���A��.
�ʴ�Ϊ���ڶ����ڵ���A�壻
��2���ǽ���Ԫ�صķǽ�����Խǿ������Ӧ����ۺ����������Խǿ���⼸��Ԫ�طǽ�
������ǿ����ClԪ�أ���������ۺ������������ǿ���Ǹ�����HClO4���ǽ�����Խ������̬�⻯�ﻹԭ��Խǿ����ԭ����ǿ����̬�⻯�������� H2S��
�ʴ�Ϊ��HClO4��H2S��
��3��Y�ĵ���O3��G�ĵ���Cl2�������γɵ�ClO2������������
�ʴ�Ϊ��Cl2��O3��ClO2��ȡ����������ֶ��ɣ���
��4��ZXΪNaH���������ӻ���������������⸺���ӹ��ɣ�����ʽΪ![]() ��
��
Na��ˮ��Ӧ��������������������Ӧ��ѧ����ʽΪΪ��NaH+H2O=NaOH+H2����
�ʴ�Ϊ��![]() ��NaH+H2O=NaOH+H2����
��NaH+H2O=NaOH+H2����
��5������״̬�£�Z�ĵ��ʺ�FeG2����ɿɳ���أ���ط�ӦΪ��![]() �����Էŵ�ʱ����ص�������ӦΪ��Fe2++2e-=Fe��
�����Էŵ�ʱ����ص�������ӦΪ��Fe2++2e-=Fe��
�ʴ�Ϊ��Fe2++2e-=Fe��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ϩ�ɱ����Ը��������Һ����ΪCO2������������ȥ�����л��е�������ϩ�IJ��������ǣ� ��
A. ���������ͨ��ʢ�������ϴ��ƿ
B. ���������ͨ��ʢ��������ˮ��ϴ��ƿ
C. ���������ͨ��ʢ��ˮ��ϴ��ƿ
D. ���������ͨ��ʢ�����Ը�����ص�ϴ��ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л����ﲻ���ɶ�ӦԪ�ص���ֱ�ӻ������ɵ���()
A��Cu2S B��FeCl3 C��Fe2S3 D��HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2016����ɽ��ģ��[��ѧѡ��3���ʽṹ������]
��Ȼ���д��ڴ����Ľ���Ԫ�أ������ơ�þ����������ͭ���ڹ�ũҵ���������Ź㷺��Ӧ�á�
��1����д��Fe�Ļ�̬ԭ�Ӻ�������Ų�ʽ ��
��2������A��ԭ��ֻ��3�����Ӳ㣬���һ�����ĵ��������£�
�����ܣ�KJ/mol�� | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
��Aԭ�ӵļ۵����Ų�ʽΪ ��
��3���ϳɰ���ҵ�У�ԭ������N2��H2������CO��NH3�Ļ�������ڽ���ϳ���ǰ���ô��������ͭ��I����Һ������ԭ�������е�CO(Ac-����CH3COO-)���䷴Ӧ�ǣ�[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac[�����ʻ�������ͭ��I��] ��H<0
[Cu(NH3)3CO]Ac[�����ʻ�������ͭ��I��] ��H<0
��C��N��O����Ԫ�صĵ�һ��������С�����˳��Ϊ
�������[Cu(NH3)3CO]Ac����ԭ�ӵ���λ��Ϊ
����һ��������NH3��CO2�ܺϳ�����[CO(NH2)2]��������Cԭ����Nԭ�ӹ�����ӻ����ͷֱ�Ϊ ��1mol���ط����У��Ҽ�����ĿΪ NA��
��4��NaCl��MgO���������ӻ����NaCl���۵�Ϊ801.3����MgO���۵�ߴ�2800����������־����۵������Ҫԭ���� ��
��5����NH4��2SO4��NH4NO3�ȿ����P�ﳾ������������������NH4+�Ŀռ乹���� ������������������NO3-��Ϊ�ȵ�����ķ����� �����ѧʽ��
��6��ͭ�Ļ���������ܶ࣬��ͼ��������ͭ�ľ����ṹ����֪�������ⳤΪa cm�����⻯��ͭ�ܶȵļ���ʽΪ��= g/cm3.(��NA��ʾ����ӵ�����)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ�������������������ʣ�ѡ�õ��Լ���ȷ���ǣ� ��
ѡ�� | ���ʣ����ʣ� | �Լ� |
A | Al2O3��SiO2�� | NaOH��Һ |
B | FeCl2��Һ��FeCl3�� | Fe�� |
C | CO2��SO2�� | Na2CO3��Һ |
D | NaHCO3��Һ��Na2CO3�� | Ca��OH��2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ���ش��������⣺

��1��TԪ�ص����ӽṹʾ��ͼΪ__________��
��2��Ԫ�صķǽ�����(ԭ�ӵõ��ӵ�����)��Q ________W(����ǿ��������������)��
��3��W�ĵ�����������������ˮ����Ũ��Һ�����ܷ�����Ӧ�������������ʣ�����һ�������壬�÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________
��4��ԭ��������R��1��Ԫ�ص�һ���⻯���ֽܷ�Ϊ������һ���⻯��˷ֽⷴӦ�Ļ�ѧ����ʽ��________________________________________________�䷴Ӧ��ĵ���ʽΪ �����Ӱ뾶T3+__________R3-����������������������������
��5��R�ж�����������м���Է���������С����һ�������£�2 L�ļ�������0.5 L���������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û����������������ɵ�R�ĺ�������ֻ��һ�֣���ú������εĻ�ѧʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ϴ�����58.2%��SiO2��21.0%��ZnO��4.5%��ZnS��12.8%��CuS��ijͬѧ��15.0 g�÷ϴ���Ϊԭ�ϣ��������е�п��ͭ�����õ�ʵ�鷽�����£�

�ش��������⣺
��1��������װ���У���һ�ν���������____________���ڶ��ν���Ӧѡ��____________�������ţ�

��2���ڶ��ν���ʱ����ʢ����Һ1�ķ�Ӧ���м���ϡ���ᣬ��������������Һ����˳���෴�������___________������2����Ҫ�ɷ���____________________��
��3��Ũ������п������ͭ��Һʹ�õ�����������________________��
��4��ijͬѧ��ʵ�����֮�õ�1.5gCuSO4�q5H2O,��ͭ�Ļ�����Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ���о�С����̽��CuSO4��Һ��Na2CO3��Һ��ϲ���������ɫ������ɣ�С���������ʵ��̽����
��������衿
����1������ΪCu(OH)2
����2������Ϊ
����3������Ϊ��ʽ̼��ͭ[��ѧʽ�ɱ�ʾΪnCuCO3mCu(OH)2]
���������ϡ���������һ�ֳ������Ⱦ��ֽ⣨����������ᾧˮ����
�����ʳɷ�̽����
����1������������Һ���ˣ�������ˮϴ�ӣ�������ˮ�Ҵ�ϴ��
����2����ͬѧȡһ�������壬�����������õ���ͼװ�ã��г�����δ���������ж���ʵ�顣

��ش��������⣺
��1������2�еij���Ϊ ��
��2������1�г���ΪCu(OH)2������������ ��
��3����ˮ�Ҵ�ϴ�ӵ�Ŀ��____ __��
��4������Ӧ��A������ɫ�����ڣ�C������������֤������______����д��ţ�������
��5����ͬѧ��ΪֻҪ����ͼ��Bװ�õ��Լ����� �Լ������֤�������м��衣
��6����ͬѧ����B�Լ�����֤����3������ʵ�������� ��
��7���ڼ���3������ǰ���£�ijͬѧ������Ba(OH)2����Ca(OH)2���ⶨ����ɫ����Ļ�ѧʽ������ȡ����ɫ��������Ϊ27.1g��ʵ�������װ��B����������2.7g��C�еIJ�������������Ϊ19.7g���������ɫ����Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�����þ��й���ǰ����
��1����ͼ�ǴӺ�ˮ����ȡþ�ļ�������

����ҵ�ϳ����ڳ���Mg2+���Լ�A�� ��Mg��OH��2ת��ΪMgCl2�����ӷ���ʽ�� ��
������ˮMgCl2��ȡMg�Ļ�ѧ����ʽ�� ��
��2���������и�����I����ʽ���ڵĵ�Ԫ����ʵ������ȡI2��;��������ʾ��
�ɺ���![]() ������
������![]() ��Һ
��Һ![]()
![]()
![]() I2
I2
�����պ������ҽ�ʱ���õ���Ҫ���������� ��
�����ữ����Һ�мӹ���������Һ��д���÷�Ӧ�����ӷ���ʽ ��
����Ӧ��������CCl4����ȡ����������ȡ����Һ�ķ����ӵ�ˮ����ȡ�⣬��Ҫ����������ͼ��

�ס��ҡ���3��ʵ������У�����ȷ���� ����ס������ҡ���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com