
【题目】【2016届唐山二模】[化学选修3物质结构与性质]
自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式 。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为 。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac[醋酸羰基三安合铜(I)] △H<0
[Cu(NH3)3CO]Ac[醋酸羰基三安合铜(I)] △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为
③在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为 ;1mol尿素分子中,σ键的数目为 NA。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是 。
(5)(NH4)2SO4、NH4NO3等颗粒物及扬尘等易引起雾霾。其中NH4+的空间构型是 (用文字描述),与NO3-互为等电子体的分子是 。(填化学式)
(6)铜的化合物种类很多,右图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氢化亚铜密度的计算式为ρ= g/cm3.(用NA表示阿佛加德罗常数)

【答案】(15分)(除标注外其余每空2分)(1)[Ar]3d64s2 (1分);(2)3s2(1分)
(3)①C<O<N ; ②4 ;③sp2杂化、 sp3杂化; 7;
(4)MgO晶体所含离子半径小,电荷数多,晶格能大 (1分)
(5)正四面体;(1分) SO3或者BF3 (1分)(其它合理答案也给分) (6)![]()
【解析】
试题分析:(1) Fe是26号元素,根据原子核外电子排布能级图可知,Fe的基态原子核外电子排布式是[Ar]3d64s2 (2) A原子核外有3个电子层,根据原子核外电子的电离能大小关系可知:第一电离能与第二电离能相对较小,而第三电离能较第二电离能大很多,说明原子最外层只有2个电子,所以A的价电子排布式为3s2,(3) ①C、N、O三种元素是同一周期的元素,一般情况下,原子序数越大,元素的第一电离能就越大,而N元素的原子最外层电子处于其轨道的半充满的稳定状态,失去电子比O还大,所以三种元素的第一电离能由小到大的顺序为C<O<N ;②配合物[Cu(NH3)3CO]Ac中心原子Cu结合了3个氨分子和一个CO分子,所以其配位数为3+1=4;尿素的结构简式是 ,可见在物质分子中C原子形成了一个碳氧双键和2个碳氮碱,其C原子杂化类型是sp2;N原子最外层有5个电子,其中一个呗孤对电子占据,其余三个被3个共价键占据,N原子的轨道的杂化类型分别为 sp3杂化;在一个尿素分子中含有7个σ键,1个π键,所以1mol该物质中含有的σ键的数目为7NA;(4) NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,离子键的键能大,断裂消耗较高的能量;(5) NH4+的N原子是sp3杂化,其空间构型是正四面体;由于等电子体是原子数相同,原子最外层电子数也相等的微粒,所以与NO3-互为等电子体的分子是SO3或BF3 ;(6)根据CuCl晶胞结构可知,在一个晶胞中含有Cu+数目是:8×1/8+6×1/3=4.含有Cl-数目是1×4=4,所以一个晶胞中含有4个CuCl,根据晶体密度计算公式:
,可见在物质分子中C原子形成了一个碳氧双键和2个碳氮碱,其C原子杂化类型是sp2;N原子最外层有5个电子,其中一个呗孤对电子占据,其余三个被3个共价键占据,N原子的轨道的杂化类型分别为 sp3杂化;在一个尿素分子中含有7个σ键,1个π键,所以1mol该物质中含有的σ键的数目为7NA;(4) NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是MgO晶体所含离子半径小,电荷数多,离子键的键能大,断裂消耗较高的能量;(5) NH4+的N原子是sp3杂化,其空间构型是正四面体;由于等电子体是原子数相同,原子最外层电子数也相等的微粒,所以与NO3-互为等电子体的分子是SO3或BF3 ;(6)根据CuCl晶胞结构可知,在一个晶胞中含有Cu+数目是:8×1/8+6×1/3=4.含有Cl-数目是1×4=4,所以一个晶胞中含有4个CuCl,根据晶体密度计算公式: 。
。


科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或应用的说法正确的是
A.晶体硅是光纤制品的主要化学成分 B.合金至少含两种以上的金属元素
C.胶体可产生丁达尔效应 D.石油分馏可获得乙烯、丙烷和丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是航空、军工、电力等领域的重要原料。工业上用钛酸亚铁(FeTiO3)冶炼钛(Ti)的过程是:①2FeTiO3+6C+7Cl2![]() 2TiCl4+2FeCl3+6CO
2TiCl4+2FeCl3+6CO
②在氩气环境中,2Mg+TiCl4![]() Ti+2MgCl2
Ti+2MgCl2
下列判断不正确的是( )
A.反应②属于置换反应
B.反应②中氯化物的总质量保持不变
C.反应①、②中钛元素的化合价都改变
D.反应②中,氩气只作为保护气并不参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个选项是在不同的情况下对化学反应3A(g)+B(g)![]() 2C(g)+2D(g)测得的用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是( )
2C(g)+2D(g)测得的用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是( )
A.v(D)=0.5mol·L-1.s-1
B.v(C)=3.0 mol·L-1·min-1
C.v(B)=0.30 mol·L-1.s-1
D.v(A)=0.60 mol·L-1.s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.无论乙烯的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关
B.无论使用溴的四氯化碳溶液还是酸性KMnO4溶液都可以鉴别乙烯和乙烷
C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D.乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。回答下列问题:
(1) Y在元素周期表中的位置为_____________________________.
(2) 上述元素的最高价氧化物对应的水化物酸性最强的是_____________________ (写化学式),非金属气态氢化物还原性最强的是_________________(写化学式)。
(3) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有__________________ (写出其中两种物质的化学式))。
(4) ZX的电子式为_________________;ZX与水反应放出气体的化学方程式为_____________。
(5) 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),放电时,电池的正极反应
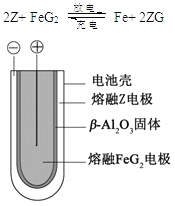
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素, 它们的原子序数依次增大。 已知A和B原子具有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍, C是该周期中原子半径最大的元素, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物,E与D相邻。 试根据以上叙述回答:
(1)元素名称: A C __________ E
(2)写出AB2与过量氢氧化钠溶液反应的离子方程式 ;写出 C2B2与AB2反应的化学方程式 ;
(3)画出D的原子结构示意图 ,用电子式表示化合物 C2D 的形成过程 ;
(4)D、E的气态氢化物的稳定性 大于 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com