
【题目】以NA代表阿伏加德罗常数的数值,则关于热化学方程式C2H2(g)+![]() O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1的说法中正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1的说法中正确的是( )
A.有10NA个电子转移时,放热1 300 kJ
B.有NA个水分子生成且为液体时,吸热1 300 kJ
C.有2NA个碳氧共用电子对生成时,放热1 300 kJ
D.有6NA个碳氧共用电子对生成时,放热1 300 kJ
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是__________(填“增大”、“减小”或“不变”,下同),ΔH的变化是__________。请写出NO2和CO反应的热化学方程式___________________。

(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为_______________。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |

已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=__________ kJ·mol-1(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质相互混合后,能发生离子反应的是( )
A.碳和氧化铜混合高温加热
B.硫酸钾溶液和氯化镁溶液
C.硫酸钠溶液和硝酸铁溶液
D.氢氧化钠溶液和硝酸铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
反应1: Fe2O3(s)+3C(石墨,s) ![]() 2Fe(s)+3CO(g) △H1
2Fe(s)+3CO(g) △H1
反应2: C(石墨,s)+CO2(g)![]() 2CO(g) △H2
2CO(g) △H2
①△H= _________(用含△H1、 △H2代数式表示)
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO (Fe足量),则平衡_________移动(填“正向”或“逆向”),达到新平衡后c(CO)将_________(填“变大”、“变小”或“不变”)
(2)在T℃时,反应 Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为_________
②下列说法正确的是_________(填字母)。
A.若容器压强恒定,说明反应达到平衡状态
B.增加Fe2O3的量能提高CO的转化率
C.甲容器中CO的平衡转化率大于乙的平衡转化率
D.若容器中固体质量不再改变,说明反应达到平衡状态
③取五等份CO,分别加入温度不同但容积相同的恒容密闭容器中(已装有足量Fe2O3),反应相同时间后,分别测定体系中CO的体积分数(CO%),并作出其随反应温度(T)变化的关系图,请在答题卡中作出平衡时混合气体的平均相对分子质量随反应温度(T)的变化示意图。
_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液中,c(Cl﹣)最大的是( )
A.500mL1mol/L KCl
B.800mL0.5mol/L MgCl2
C.250mL1mol/L FeCl3
D.200mL1mol/LCaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.SO2常用于纸张等植物纤维的漂白
B.工业上可用铝热反应大规模炼铁
C.光导纤维的主要成允是SiO2
D.电解熔融MgCl2 , 可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的工业原料,其结构简式如图:
试回答下列问题:
(1)有机物A的分子式为____;
(2)有机物A中含有的含氧官能团名称是_____________________;
(3)1 mol 该物质与足量金属钠反应,能生成标准状况下的氢气______L;
(4)该物质能发生的反应有____(填序号)。
①能与NaOH溶液反应 ②能发生水解反应 ③能与甲醇发生酯化反应
④可以燃烧 ⑤能与溴的四氯化碳溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1无色透明溶液中能大量共存的离子组是( )
A.Al3+、Ag+、NO3﹣、Cl﹣
B.Mg2+、NH4+、NO3﹣、Cl﹣
C.Ba2+、K+、S2﹣、Cl﹣
D.Cu2+、Na+、NO3﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-乙氧基乙酰乙酰苯胺(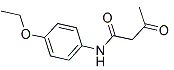 ),简称AAPP,常用作染料、有机颜料中间体。其合成路线如下:
),简称AAPP,常用作染料、有机颜料中间体。其合成路线如下:
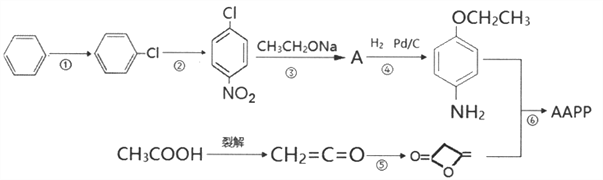
已知: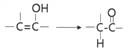
回答下列问题:
(1)下列有关说法正确的是_________
A.反应③是取代反应,反应⑤是加成反应
B.1mol苯完全燃烧需要6molO2
C.CH3COOH不能与新制Cu(OH)2浊液反应
D.CH2=C=O在一定条件下能生成乙醇
(2)反应②的反应条件是_________
(3)A的结构简式_________
(4)反应⑥的化学方程式_________
(5)![]() 有多种同分异构体,写出三种符合下列要求的同分异构体_________
有多种同分异构体,写出三种符合下列要求的同分异构体_________
a.链状化合物 b.能发生银镜反应,但不能在稀硫酸中水解 c.不能与Na反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com