
A.胆矾的研磨与溶解 B.氢氧化铜沉淀的生成
C.进行热分解 D.过滤氧化铜固体
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省温州市高三第一次适应性测试理综化学试卷(解析版) 题型:填空题
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
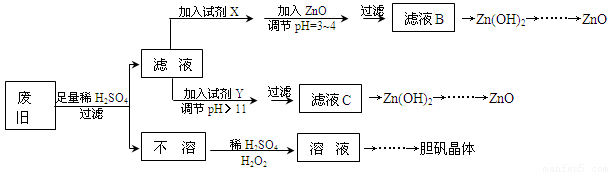
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| Fe3+ | Fe2+ | Zn2+ |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)试剂X可能是__________,其作用是____________________。
(2)加入ZnO调节pH=3~4的目的是____________________。
(3)由不溶物生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
(5)下列试剂可作为Y试剂的是______。
A.ZnOB.NaOHC.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
2Cu2++4I-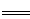 2CuI(白色)↓+I2,I2+2S2O32-
2CuI(白色)↓+I2,I2+2S2O32- 2I-+S4O62-
2I-+S4O62-
①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:填空题
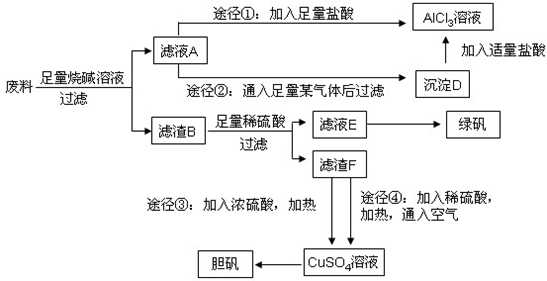
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:

(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体(固态时可用于人工降雨),写出该气体的电子式 。你认为较合理的途径是 (填①或②),理由是: 。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了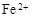 和
和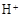 外,还可能存在
(用离子符号表示),检测该离子的方法是
。
外,还可能存在
(用离子符号表示),检测该离子的方法是
。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 、 。
(5)途径④发生的反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com