
在1L密闭容器中,把l mol A和1 mol B混合发生如下反应:
3A(g) + B(g)  XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是
XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是
| A.x的值为2 | B.A的转化率为40% |
| C.B的平衡浓度为0.8 mol/L | D.达到平衡时D的体积分数为20% |
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:单选题
在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0。
CO2(g)+H2(g) △H<0。
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K= 。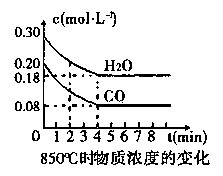
0~4 min的平均反应速率v(CO)= mol·L-1·min-1。若降低温度,该反应的K值将 ,该反应的化学反应速率将 (填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表。
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为 ( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为 ( )
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
| A.Z和W在该条件下至少有一个是为气态 |
| B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等 |
| C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 |
| D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应N2+3H2 2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
| A.v(NH3)="0.2" mol/(L·s) | B.v(N2)="1.0" mol/(L·min) |
| C.v(H2)="1.67" mol/(L·min) | D.v(H2)="0.3" mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,C0与H2反应可生成乙醇:2CO+4H2? CH3CH20H+H20。下列关于该反应的说法错误的是
| A.增大CO的浓度能减小反应速率 |
| B.升高体系温度能增大反应速率 |
| C.使用合适的催化剂可增大反应速率 |
| D.若反应在密闭容器中进行,H2和C0不能全部转化为产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | | 无 |
| ③ | 10 mL 5% H2O2溶液 | MnO2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
T℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为Tl和T2时,Y的体积分数 (Y)与时间的关系如图2所示。则下列结论错误的是
(Y)与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.反应进行的前4min内,用X表示的反应速率v(X)=0.15mo1?(L?min)—1 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是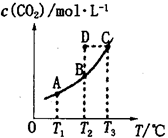
| A.平衡状态A与C相比,平衡状态A的c(CO)小 |
| B.在T2时,若反应处于状态D,则一定有v正<v逆 |
C.反应CO(g)+H2O(g) CO2(g)+H2(g)△H>0 CO2(g)+H2(g)△H>0 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com