
��һ���Ϊ10 L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��
CO(g)+H2O(g) CO2(g)+H2(g) ��H<0��
CO2(g)+H2(g) ��H<0��
��1��CO��H2OŨ�ȱ仯��ͼ�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K= ��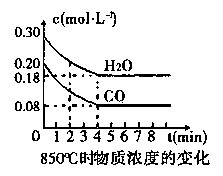
0��4 min��ƽ����Ӧ����v(CO)= mol��L-1��min-1���������¶ȣ��÷�Ӧ��Kֵ�� ���÷�Ӧ�Ļ�ѧ��Ӧ���ʽ� (�������С�����䡱)��
��2������ͬ�����з���������Ӧ�����¶ȸ���850��ʱ�������ڸ����ʵ�Ũ�ȱ仯���±���
| ʱ��(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
��1��1 0.03 ���� ��С
��2����ƽ�� ���� ��d
��3���� ����
��Ϊ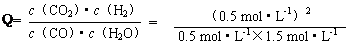
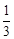 ��K����Ӧ���ҽ��С�
��K����Ӧ���ҽ��С�
���������������1����ͼ����֪��CO��H2OŨ���ڴﵽƽ��ʱ��Ũ�ȷֱ�Ϊ0.08 mol/L��0.18mol/L����Ӧ���ɵ�CO2��H2��Ϊ0.12mol/L�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K=0.12��0.12/��0.08��0.18��=1��0��4min��ƽ����Ӧ����v(CO)����0.20-0.08��/4=0.03mol��L-1��min-1����H<0��˵���÷�ӦΪ���ȷ�Ӧ�����Խ����¶ȣ��÷�Ӧ��Kֵ�������¶Ƚ��ͣ���ѧ��Ӧ���ʼ�С��
��2����Ϊ3min��4min�����ʵ�Ũ����ȣ�����3min��4min֮�䷴Ӧ����ƽ��״̬��c 1��ֵ����0.08 mol��L-1����Ϊǰ�����ӵ�CO��ѧ��Ӧ����Ϊ��0.200-0.138��/2=0.031mol��L-1��min-1������һ����ӦŨ�ȼ��٣���ѧ��Ӧ����Ҳ���٣���c 1��ֵ����ֵΪ0.08 mol��L-1��������2-3min��ƽ����ѧ����Ϊ��0.138-0.08��/1=0.058mol��L-1��min-1����������Dz����ܷ����ģ�����c 1��ֵ����0.08 mol��L-1��
�ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������ܵ�ԭ����Ϊ��������Ũ�ȣ���Ϊ�����Ũ�Ⱦ�������Ӧ��֮һ��CO��Ũ�ȼ��٣�������������Ũ�ȣ��ʱ���Ĵ�ѡ��d��
��3������ͬ�¶��£�850�棩��ƽ�ⳣ��Ϊ1����Ϊ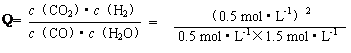 =
=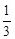 ��K=1�����Ը÷�Ӧδ�ﵽ��ѧƽ�⣬��ʱv������>v���棩����Ӧ���ҽ��С�
��K=1�����Ը÷�Ӧδ�ﵽ��ѧƽ�⣬��ʱv������>v���棩����Ӧ���ҽ��С�
���㣺��ѧƽ�⣬��ѧƽ�ⳣ���ļ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��Ӧ��2H2(g)+O2(g)��2H2O(l)����H= -571.6kJ��mol-1�����ж��ڷ�Ӧ2H2O(l)��2H2(g)+O2(g)��˵������ȷ����
| A�����ȷ�Ӧ | B����S��0 |
| C��ֻ���ڵ�������½��� | D����һ���¶��¿����Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
2SO2+O2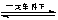 2SO3�ǽӴ��������Ṥ���е���Ҫ��Ӧ�����й��ڸ÷�Ӧ��˵���д������
2SO3�ǽӴ��������Ṥ���е���Ҫ��Ӧ�����й��ڸ÷�Ӧ��˵���д������
| A������SO2��Ũ���ܼӿ�÷�Ӧ������ |
| B��ͨ��ʹ���������� |
| C��������ϵ�¶Ȼ�����÷�Ӧ������ |
| D��ʹ�ô����ܸı�÷�Ӧ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�������·�Ӧ���Խ��е�ԭ������ɳ����ԭ�����͵���
| A�������ᷴӦ�������� |
| B����������ȼ�� |
| C���������ṯ��Һ�б����γ������� |
| D��һ���¶��£������������Ʒ�Ӧ�Ƶý����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ĸ���ͬ�������У��ֱ���в�ͬ�����µĺϳɰ���ӦN2(g)+3H2(g) 2NH3(g)������ͬʱ���ڱ�ʾ�÷�Ӧ����������
2NH3(g)������ͬʱ���ڱ�ʾ�÷�Ӧ����������
| A��v(H2)=0��1 mol/(L��s) | B��v(N2)=0��1 mol/(L��s) |
| C��v(N2)=0��2 mol/(L��s) | D��v(NH3)=0��3 mol/(L��s) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ܱ������У�ʹ2 mol N2��6 mol H2��Ϸ������з�Ӧ:N2(g)+3H2(g) 2NH3(g)(����ӦΪ���ȷ�Ӧ)������˵���������
2NH3(g)(����ӦΪ���ȷ�Ӧ)������˵���������
| A������ƽ����ϵ���¶�(�����������)����������ƽ����Է���������� |
| B������ƽ����ϵ���¶�(�����������)�����������ܶȲ��䡡 |
| C������Ӧ�ﵽƽ��ʱ��N2��H2��Ũ�ȱ��ǡ�1��3 |
| D�����ﵽƽ��ʱ�����������������ѹǿ���䣬ƽ�⽫�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��1L�ܱ������У���l mol A��1 mol B��Ϸ������·�Ӧ��
3A(g) + B(g)  XC(g) + 2D(g)������Ӧ�ﵽƽ��ʱ������0.4 mol D�������C��ƽ��Ũ��Ϊ0.4 mol/L����������������ȷ����
XC(g) + 2D(g)������Ӧ�ﵽƽ��ʱ������0.4 mol D�������C��ƽ��Ũ��Ϊ0.4 mol/L����������������ȷ����
| A��x��ֵΪ2 | B��A��ת����Ϊ40% |
| C��B��ƽ��Ũ��Ϊ0.8 mol/L | D���ﵽƽ��ʱD���������Ϊ20% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��5 mL 0.1 mol��L-1 KI��Һ�еμ�0.1 mol��L-1 FeCl3��Һ5~6�κ�,�ٽ�������ʵ��,���п�֤��FeCl3��KI�ķ�Ӧ�ǿ��淴Ӧ��ʵ��(������)��(����)
| A���μ�AgNO3��Һ,�л�ɫ�������� |
| B������CCl4��,�²�Һ��Ϊdz��ɫ |
| C������CCl4��,�²�Һ��Ϊdz��ɫ;ȡ�ϲ���Һ,�μ�AgNO3��Һ,�а�ɫ�������� |
| D������CCl4��,�²�Һ��Ϊdz��ɫ;ȡ�ϲ���Һ,�μ�KSCN��Һ,��Һ�Ժ�ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ҵ�ϳ��û�ԭ����������������ˮ(Cr2 ��Cr
��Cr ),������Ϊ:Cr
),������Ϊ:Cr
 Cr2
Cr2
 Cr3+
Cr3+ Cr(OH)3��
Cr(OH)3��
��֪:
(1)������д���ƽ��:2Cr (��ɫ)+2H+
(��ɫ)+2H+ Cr2
Cr2 (��ɫ)+H2O
(��ɫ)+H2O
(2)��������ɵ�Cr(OH)3����Һ�д������³����ܽ�ƽ��:
Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)������,Cr(OH)3���ܶȻ�Ksp=10-32;�ҵ���Һ������Ũ��С��10-5 mol��L-1ʱ�����������Ӳ�����
�����й�˵������ȷ����(����)
A��������м���,����Һ��pH������2,��Һ�Ի�ɫ,Cr Ũ������ Ũ������ |
B��������е�2v(Cr )=v(Cr2 )=v(Cr2 )ʱ,˵����Ӧ2Cr )ʱ,˵����Ӧ2Cr (��ɫ)+2H+ (��ɫ)+2H+ Cr2 Cr2 (��ɫ)+H2O�ﵽƽ��״̬ (��ɫ)+H2O�ﵽƽ��״̬ |
C���������,��Ҫ��ԭ1 mol Cr2 ,��Ҫ12 mol (NH4)2Fe(SO4)2��6H2O ,��Ҫ12 mol (NH4)2Fe(SO4)2��6H2O |
| D���������,������Һ��pH������6ʱ,�����Ϊ��ˮ�еĸ��ѳ��� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com