

| 3.94g |
| 197g/mol |
| 2g |
| 8g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
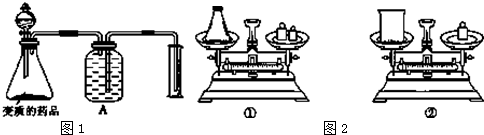
科目:高中化学 来源: 题型:
| A、在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B、在强碱溶液中:Na+、K+、AlO2-、CO32- |
| C、在有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- |
| D、在酸性溶液中:K+、MnO4-、Fe2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
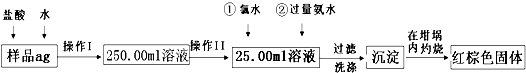
查看答案和解析>>
科目:高中化学 来源: 题型:
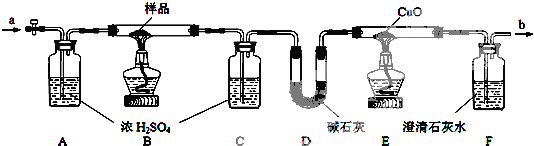
| 样品的质量 | C装置增重 | D装置增重 | E装置减轻 |
| 12.6g | 5.4g | 4.4g | 1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组利用如图所示的装置进行乙醇的催化氧化实验制取乙醛 (试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气.请填写下列空白:
某课外活动小组利用如图所示的装置进行乙醇的催化氧化实验制取乙醛 (试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气.请填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com