
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
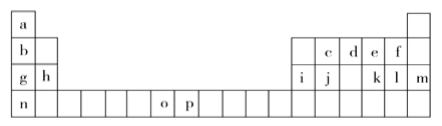
(1)基态o原子的外围电子排布图________________________;基态p3+的最外层电子排布式___________________;n的原子结构示意图____________________。在以上元素中,没有未成对电子的元素有______种。
(2)原子序数为52的元素x在元素周期表中与以上________________元素在同一族(填写以上表中字母对应的元素符号)。
(3)上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p),则I3(o)__I3(p)(填“>”或“<”)。理由是_________________________________________________。
(4)将以上周期表中g、h、i、j四种元素的电负性由大到小排序____________________(用元素符号表示),第一电离能由大到小排序________________________(用元素符号表示)。
【答案】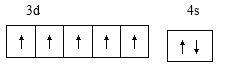 3s23p63d5
3s23p63d5 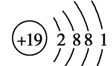 2 O或S > Mn2+的3d轨道电子排布为半充满状态,比较稳定 Si> Al > Mg >Na Si>Mg>Al>Na
2 O或S > Mn2+的3d轨道电子排布为半充满状态,比较稳定 Si> Al > Mg >Na Si>Mg>Al>Na
【解析】
(1)o、p、n元素分别为锰、铁和钾,原子序数分别为为25、26和19,按电子排布规律写基态o原子的外围电子排布图、基态p3+的最外层电子排布式及n的原子结构示意图;
(2)参照原子序数为54的元素在元素周期表是第5周期0族元素,则可推知原子序数为52的元素x的位置并据此回答;
(3)按电离能的性质和规律回答上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p)的相对大小及理由;
(4)按电负性规律和电离能的规律回答g、h、i、j四种元素的电负性由大到小排序及第一电离能由大到小排序;
根据元素周期表知,a-p各元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn 、Fe。
(1)基态o原子为锰,核电荷数为25,其电子排布简式为[Ar]3d54s2,则外围电子排布图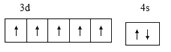 ;基态p3+ 为Fe3+,最外层电子排布式3s23p63d5;n原子为钾,核电荷数19,原子结构示意图
;基态p3+ 为Fe3+,最外层电子排布式3s23p63d5;n原子为钾,核电荷数19,原子结构示意图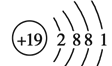 ;在以上元素中,没有未成对电子的元素有Mg、Ar两种元素,共计2种;
;在以上元素中,没有未成对电子的元素有Mg、Ar两种元素,共计2种;
答案为:  ;3s23p63d5 ;
;3s23p63d5 ; ;2;
;2;
(2)稀有气体氙,原子序数为54,位于0族,依次前推,53号元素为碘,52号元素锑,位于VIA族,与O或S同族;
答案为:O或S;
(3)o、p分别表示锰和铁元素,由于Mn2+的3d轨道电子排布为半充满状态,比较稳定,所以第三电离能分别为I3(o) >I3(p);
答案为:>;Mn2+的3d轨道电子排布为半充满状态,比较稳定;
(4)g、h、i、j四种元素分别为钠、镁、铝、硅,同一周期从左到右电负性增大,因此电负性由大到小排序:Si> Al > Mg >Na;同一周期第一电离能从左到右增大,但是IIA、 VA电离能大于邻近元素的电离能,因此第一电离能由大到小排序Si>Mg>Al>Na;
答案为:Si> Al > Mg >Na;Si>Mg>Al>Na。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
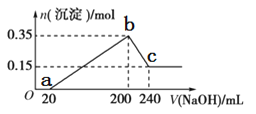
(1)写出Al与NaOH溶液反应的化学方程式___________________;
(2)镁和铝的总质量为________g;
(3)b点溶液中的溶质为__________,硫酸的物质的量浓度为___________ mol/L;
(4)生成的氢气在标准状况下的体积为__________L;
(5)c点溶液中通入足量的CO2的反应化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
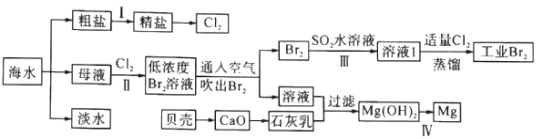
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中依次加入过量BaCl2、Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_____________。
(2)海水提溴,制得1mol Br2至少需要消耗_________mol Cl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是_________________。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为__________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(5)判断Mg(OH)2是否洗涤干净的操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是
A.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=Cu
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.饱和Na2CO3溶液与CaSO4固体反应:CO32-(aq)+CaSO4(s)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42- =BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
 +HCl
+HCl
下列有关叙述正确的是
A.I的分子式为C9H10O4
B.II中所有原子有可能均共面
C.可用FeCl3溶液鉴别有机物I和III
D.1 mol产物III与足量溴水反应,消耗Br2的物质的量为1.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。下图是以Cu作为催化剂CO2转化为甲酸的反应过程,下列有关说法不正确的是
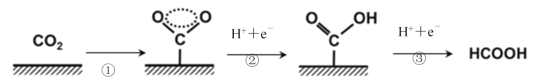
A.过程①说明在催化剂作用下,O-C-O之间形成了一种特殊的化学键
B.过程②和③吸收了能量并形成了O-H键和C-H键
C.CO2和HCOOH中均只含有极性共价键
D.每1molCO2完全转化为甲酸需得2mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“烂板液”指的是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量Cl-、Fe3+)。某化学兴趣小组用“烂板液”制取Zn(NO3)2·6H2O的过程如图:
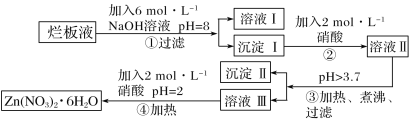
已知:Zn(NO3)2·6H2O是一种无色晶体,其水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂板液”中溶质的主要成分是___(填化学式)。
(2)在操作①中保持pH=8的目的是___。
(3)沉淀Ⅰ的主要成分是___(填化学式)。
(4)操作③中加热煮沸的目的是___;
(5)操作④保持pH=2的目的是___;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:![]() ,某溶液中含如下离子组中的几种
,某溶液中含如下离子组中的几种![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,某同学欲探究该溶液的组成进行了如下实验:
,某同学欲探究该溶液的组成进行了如下实验:
①用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰;
②另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
③取②反应后溶液置于试管中加入![]() ,充分振荡静置后溶液分层,下层为无色。
,充分振荡静置后溶液分层,下层为无色。
下列说法正确的是( )
A.②中无色气体是![]() 气体,可能含有
气体,可能含有![]() 气体
气体
B.原溶液中![]() 与
与![]() 只存在一种离子
只存在一种离子
C.原溶液中![]() 与
与![]() 至少存在一种离子
至少存在一种离子
D.为确定是否含有![]() 可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有100mLMgCl2和AlCl3的混合溶液其中c(Mg2+)=2molL-1,c(Cl-)=7molL-1,要使镁离子转化成Mg(OH)2并使Mg2+和Al3+分离开来,至少需要4molL-1的NaOH溶液
A.140 mL B.120 mL C.200 mL D.80 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com