
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
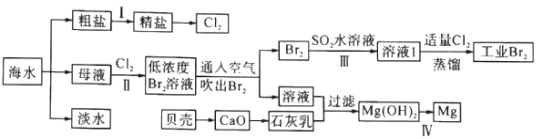
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中依次加入过量BaCl2、Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_____________。
(2)海水提溴,制得1mol Br2至少需要消耗_________mol Cl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是_________________。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为__________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(5)判断Mg(OH)2是否洗涤干净的操作是_________。
【答案】Ca2++![]() =CaCO3↓、Ba2++
=CaCO3↓、Ba2++![]() =BaCO3↓ 2 抑制氯气和水反应 Br2+
=BaCO3↓ 2 抑制氯气和水反应 Br2+![]() +H2O=
+H2O=![]() +2H++2Br NaBr(或溴化钠) D 取最后的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明沉淀已经洗涤干净
+2H++2Br NaBr(或溴化钠) D 取最后的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明沉淀已经洗涤干净
【解析】
(1)加入Na2CO3溶液可除去溶液中的Ca2+、Ba2+;
(2)流程中海水提溴,先向母液中通入Cl2将Br氧化为Br2,再用SO2将其还原为Br,最后再通入Cl2将Br氧化为Br2;根据平衡移动原理分析加入硫酸的作用;Na2SO3水溶液吸收Br2生成硫酸钠和溴化氢;
(3)氯气的氧化性大于溴,氯气与溴化钠反应生成溴和氯化钠;
(4)镁是活泼金属,氧化镁的熔点大于氯化镁,所以工业上电解熔融的氯化镁冶炼金属镁;
(5)过滤出氢氧化镁固体的母液中含有氯离子,所以可以通过检验最后一次洗涤液中是否含有氯离子判断Mg(OH)2是否洗涤干净。
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,可依次加入过量BaCl2(除去硫酸根离子)、Na2CO3(除去钙离子的多余的钡离子)、NaOH(除去镁离子),最后加适量盐酸调节溶液的pH等于7后蒸发即可,所以加入Na2CO3溶液后相关化学反应的离子方程式为:Ca2++CO![]() =CaCO3↓、Ba2++CO
=CaCO3↓、Ba2++CO![]() =BaCO3↓。
=BaCO3↓。
(2)流程中海水提溴,先向母液中通入Cl2将Br氧化为Br2,再用SO2将其还原为Br,最后再通入Cl2将Br氧化为Br2,忽略过程中的损失,所以制得1mol Br2至少需要消耗2molCl2。
因为氯气和水能发生反应,所以步骤Ⅱ中需要向母液中加入稀硫酸酸化,抑制氯气和水的反应。步骤Ⅱ若用Na2SO3水溶液吸收Br2,SO![]() 被氧化成SO
被氧化成SO![]() ,Br2被还原为Br,反应的离子方程式为:Br2+SO
,Br2被还原为Br,反应的离子方程式为:Br2+SO![]() +H2O=SO
+H2O=SO![]() +2H++2Br。
+2H++2Br。
(3)因为氯气与溴化钠反应生成溴和氯化钠,除去Br2中残留的少量Cl2,可向其中加入NaBr(或溴化钠)溶液。
(4)电解MgCl2溶液得不到单质Mg,氧化镁熔点很高,应电解熔融的MgCl2制取单质Mg,所以D项制取单质镁的方法最合适。
(5)判断Mg(OH)2是否洗涤干净,就是检验最后一次洗涤液中是否存在Cl,具体操作为:取最后一次洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明Mg(OH)2已经洗涤干净。


科目:高中化学 来源: 题型:
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6·SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。
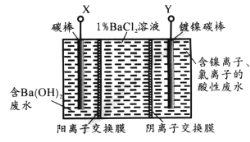
下列分析正确的是
A.X与电池的Li电极相连
B.电解过程中c(BaC12)保持不变
C.该锂离子电池正极反应为:FeS+2Li++2e =Fe +Li2S
D.若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述溶液一定呈酸性的是
A.pH=6.8的溶液
B.滴入酚酞呈无色的溶液
C.室温时,溶液中的c(H+)=1×10-2 mol·L-1
D.溶液中水电离出的c(H+)=1×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是重要的有机化工原料,在有机合成中有着广泛的应用。
I.已知:烯烃复分解反应是指在催化剂作用下,实现![]() 两边基团换位的反应:2CH2=CHCH3
两边基团换位的反应:2CH2=CHCH3![]() CH3CH=CHCH3+CH2=CH2。经测定
CH3CH=CHCH3+CH2=CH2。经测定![]() 的一种同分异构体M的核磁共振氢谱有三个峰,峰面积之比为1:3:
的一种同分异构体M的核磁共振氢谱有三个峰,峰面积之比为1:3:![]() 下图为M合成Q的流程图。
下图为M合成Q的流程图。
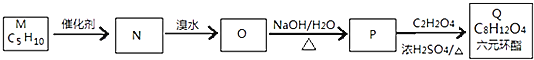
![]() 的名称为 ______ ;
的名称为 ______ ;
![]() 的化学反应类型为 ______ ;
的化学反应类型为 ______ ;
![]() 写出
写出![]() 的化学方程式 ______ 。
的化学方程式 ______ 。
![]() 有机物
有机物![]() 广泛用作香精的调香剂。实验室的科技人员利用M的一种同分异构体,通过下列流程合成有机物E。
广泛用作香精的调香剂。实验室的科技人员利用M的一种同分异构体,通过下列流程合成有机物E。
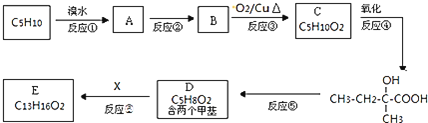
![]() 的化学方程式为 ______ ;
的化学方程式为 ______ ;
![]() 已知X的环上只有一个取代基,且取代基无支链,则E的结构简式为 ______ ;
已知X的环上只有一个取代基,且取代基无支链,则E的结构简式为 ______ ;
![]() 写出满足以下条件的X的同分异构体的结构简式: ______
写出满足以下条件的X的同分异构体的结构简式: ______
![]() 遇
遇![]() 溶液显紫色
溶液显紫色![]() 苯环上的一氯取代物只有两种。
苯环上的一氯取代物只有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)常温下,测得0.1 mol·L-1Na2A溶液的pH=8,则Na2A溶液中各离子的浓度大小关系为______________。
(2)将0.2000 mol·L-1HB溶液与0.1000 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)<c(B-)。
①混合溶液中c(B-)________(填“>”“<”或“=”)c(HB)。
②混合溶液中c(HB)+c(B-)________(填“>”“<”或“=”)2c(Na+)。
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
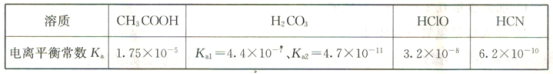
①同物质的量浓度的CH3COONa、NaClO、NaCN溶液中阴离子(不含OH-)浓度大小关系为____________。
②同pH的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是________(填字母)。
a HCN b HClO c H2CO3 d CH3COOH
③常温下物质的量浓度相同的醋酸和醋酸钠混合液的pOH=8,则c(CH3COO-)-c(CH3COOH)=____________(用数值列出计算式即可) mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2NA
B.标况下,11.2 L H2O所含电子数为5NA
C.2.4 g镁变为镁离子时失去的电子数为0.1NA
D.常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.c(Fe3+)=0.1mol/L 的溶液:![]() 、Na+、Cl、
、Na+、Cl、![]()
B.碱性溶液中:Al3+、Fe3+、![]() 、
、![]()
C.水电离出的c(H+)=1×1012mol/L的溶液:![]() 、
、![]() 、
、![]() 、Cl
、Cl
D.pH =12的溶液中:Na+、![]() Cl、
Cl、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
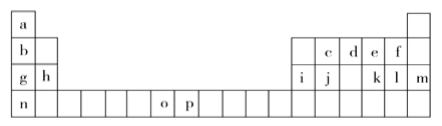
(1)基态o原子的外围电子排布图________________________;基态p3+的最外层电子排布式___________________;n的原子结构示意图____________________。在以上元素中,没有未成对电子的元素有______种。
(2)原子序数为52的元素x在元素周期表中与以上________________元素在同一族(填写以上表中字母对应的元素符号)。
(3)上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p),则I3(o)__I3(p)(填“>”或“<”)。理由是_________________________________________________。
(4)将以上周期表中g、h、i、j四种元素的电负性由大到小排序____________________(用元素符号表示),第一电离能由大到小排序________________________(用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g)![]() C4H8(g)+H2(g)
C4H8(g)+H2(g) ![]() =+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[
=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[![]() ]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
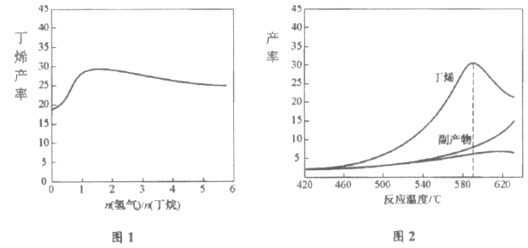
下列分析正确的是
A.随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
B.丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C.氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
D.一定温度下,控制进料比[![]() ]越小,越有利于提高丁烯的产率
]越小,越有利于提高丁烯的产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com