
【题目】下述溶液一定呈酸性的是
A.pH=6.8的溶液
B.滴入酚酞呈无色的溶液
C.室温时,溶液中的c(H+)=1×10-2 mol·L-1
D.溶液中水电离出的c(H+)=1×10-10 mol·L-1
【答案】C
【解析】
溶液中氢离子浓度大于氢氧根离子浓度时溶液显酸性。
A.未标明温度,pH=6.8只能说明氢离子的大小,不能比较氢离子和氢氧根离子浓度大小,不能说明溶液的酸碱性,故A项错误;
B.酚酞的变色范围:pH;8.2-10之间,所以滴入酚酞显无色的溶液也可能是中性溶液,故B错误;
C.室温时,![]() ,故溶液中的c(H+)=1×10-2 mol·L-1时,c(OH-)=1×10-12 mol·L-1,氢离子浓度大于氢氧根浓度,溶液显酸性,故C正确;
,故溶液中的c(H+)=1×10-2 mol·L-1时,c(OH-)=1×10-12 mol·L-1,氢离子浓度大于氢氧根浓度,溶液显酸性,故C正确;
D.溶液中水电离出的c(H+)=1×10-10 mol·L-1说明水的电离受到抑制,抑制水电离的方法有很多例如加酸或加碱,所以不能确定溶液酸碱性,故D项错误;
故答案为C。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性;
方案二:测定反应前溴水中 Br2 的物质的量和反应后溶液中 Br—离子的物质的量。
(1)方案一是否可行__________填(“是”或“否”),理由是____________________。
(2)假设测得反应前溴水中 Br2 的物质的量为 amol,
若测得反应后 n(Br-)=__________mol,则说明溴水与乙醛发生取代反应;
若测得反应后 n(Br-)=__________mol,则说明溴水与乙醛发生加成反应;
若测得反应后 n(Br-)=__________mol,则说明溴水将乙醛氧化为乙酸。
(3)按物质的量之比为 1︰5 配制 1000mLKBrO3-KBr 溶液,该溶液在酸性条件下完全反应可生成 0.5molBr2。取该溶液 10mL 加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为 100mL,准确量取其中 10mL,加入过量的 AgNO3 溶液,过滤、洗涤、干燥后称量得到固体 0.188g。若已知 CH3COOAg 易溶于水,试通过计算判断溴水与乙醛发生反应的类型为__________(选填猜想序号)。
(4)写出上述测定过程中的三个反应的离子方程式:
①KBrO3 和KBr 在酸性条件下的反应:______________________________;
②溴水与乙醛的反应:______________________________;
③测定 Br-离子含量的反应:______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种有机物的相互转化如图:
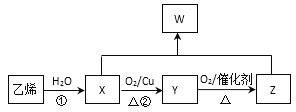
请回答:
(1)乙烯的电子式是_____________
(2)反应①的反应类型是__________
(3)X→Y的方程式是______________________
(4)X+Z→W的方程式是_____________,实验室常用图所示的装置实现这一转化
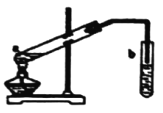
①试管b中一般加入____溶液
②从试管b中分离出W的方法是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
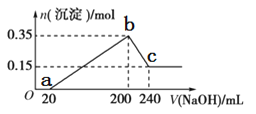
(1)写出Al与NaOH溶液反应的化学方程式___________________;
(2)镁和铝的总质量为________g;
(3)b点溶液中的溶质为__________,硫酸的物质的量浓度为___________ mol/L;
(4)生成的氢气在标准状况下的体积为__________L;
(5)c点溶液中通入足量的CO2的反应化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________,微粒之间存在的作用力是_______________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为_______________。
,0)。则D原子的坐标参数为_______________。

②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_____g·cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭是重要的化工原料,但属于不可再生能源,高效、清洁地利用煤炭资源至关重要。请回答下列问题:
(1)煤的气化。原理是C(s)+2H2(g)![]() CH4(g) ΔH。
CH4(g) ΔH。
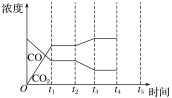
在1L密闭容器中投入1mol碳,并充入2molH2,测得相关数据如图所示。
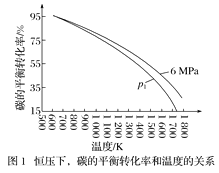

①有关图1、图2的说法正确的有___(填字母)。
a.p1<6MPa b.T1<1000K
c.ΔH<0 d.工业生产中,当温度为T2时,压强越高,经济效益越好
②图2中A点对应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)煤生产水煤气和半水煤气。
①工业上用煤生产作为合成氨原料气的水煤气,要求气体中(CO+H2)与N2的体积之比为3.1~3.2,发生的反应有C(s)+H2O(g)![]() CO(g)+H2(g),C(s)+
CO(g)+H2(g),C(s)+![]() O2(g)
O2(g)![]() CO(g)。从能量角度考虑,通入空气的目的是___。
CO(g)。从能量角度考虑,通入空气的目的是___。
②如图是反应CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH<0中CO和CO2的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是___(写出1种即可)。若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质名称(假设各物质状态均保持不变)。___
H2(g)+CO2(g) ΔH<0中CO和CO2的浓度随时间发生变化的曲线,则t2时刻改变的条件可能是___(写出1种即可)。若t4时刻通过改变容积的方法将压强增大为原来的2倍,在图中t4~t5区间内画出CO、CO2浓度变化曲线,并标明物质名称(假设各物质状态均保持不变)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
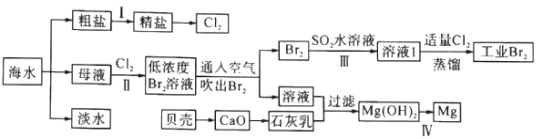
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中依次加入过量BaCl2、Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_____________。
(2)海水提溴,制得1mol Br2至少需要消耗_________mol Cl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是_________________。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为__________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(5)判断Mg(OH)2是否洗涤干净的操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“烂板液”指的是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量Cl-、Fe3+)。某化学兴趣小组用“烂板液”制取Zn(NO3)2·6H2O的过程如图:
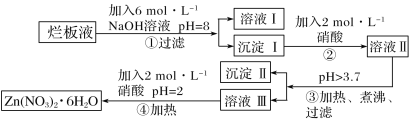
已知:Zn(NO3)2·6H2O是一种无色晶体,其水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂板液”中溶质的主要成分是___(填化学式)。
(2)在操作①中保持pH=8的目的是___。
(3)沉淀Ⅰ的主要成分是___(填化学式)。
(4)操作③中加热煮沸的目的是___;
(5)操作④保持pH=2的目的是___;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com