
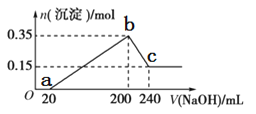
【题目】将一定质量的镁铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
(1)写出Al与NaOH溶液反应的化学方程式___________________;
(2)镁和铝的总质量为________g;
(3)b点溶液中的溶质为__________,硫酸的物质的量浓度为___________ mol/L;
(4)生成的氢气在标准状况下的体积为__________L;
(5)c点溶液中通入足量的CO2的反应化学方程式为___________。
【答案】2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 9 Na2SO4 2.5 10.08 NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
【解析】
由图象可知,从开始至加入NaOH溶液20 mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后有剩余,溶液的溶质为H2SO4、MgSO4、Al2(SO4)3,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;当V(NaOH溶液)=200 mL时,沉淀量最大,此过程中Mg2+、Al3+与OH-反应生成Mg(OH)2和Al(OH)3,溶液溶质为Na2SO4;从200 mL到240 mL,NaOH溶解固体Al(OH)3,发生反应:OH-+ Al(OH)3=AlO2-+2H2O,据此分析解答。
(1)Al与NaOH溶液反应产生NaAlO2和H2,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)根据图象可知Mg(OH)2和Al(OH)3的物质的量之和为0.35 mol,从200 mL到240 mL,NaOH溶解Al(OH)3,当V(NaOH溶液)=240 mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15 mol,Al(OH)3的物质的量为0.35 mol-0.15 mol=0.2 mol,由元素守恒可知n(Al)=n[Al(OH)3]=0.20 mol,n(Mg)=n[Mg(OH)2]=0.15 mol,所以镁和铝的总质量为m(Al)+m(Mg)=0.20 mol×27 g/mol+0.15 mol×24 g/mol=9 g;
(3)沉淀量最大时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200 mLNaOH溶液中含有的n(NaOH)的0.5倍,所以n(Na2SO4)=0.5×5 mol/L×0.2 L =0.5 mol,所以H2SO4的物质的量浓度c(H2SO4)=![]() =2.5 mol/L;
=2.5 mol/L;
(4)根据以上分析,n(Al)=0.2 mol,n(Mg)=0.15 mol,由于Al是+3价金属,Mg是+2价的金属,所以金属失去电子的物质的量n(e-)=3n(Al)+2n(Mg)=0.2 mol×3+ 0.15 mol×2=0.9 mol,根据反应过程中得失电子守恒,可知反应产生氢气的物质的量n(H2)=![]() n(e-)=0.45 mol,则在标准状况下的体积V(H2)=0.45 mol×22.4 L/mol=10.08 L;
n(e-)=0.45 mol,则在标准状况下的体积V(H2)=0.45 mol×22.4 L/mol=10.08 L;
(5)在b点时溶液中溶质为Na2SO4,沉淀量为Mg(OH)2和Al(OH)3,在b→c过程中发生反应:NaOH+Al(OH)3=NaAlO2+2H2O,至c点,该反应恰好反应完全,故c点溶液的溶质为Na2SO4、NaAlO2,由于酸性:H2CO3>Al(OH)3,所以c点溶液中通入足量的CO2,NaAlO2、CO2、H2O反应产生Al(OH)3和NaHCO3,反应的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3。


科目:高中化学 来源: 题型:
【题目】海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O=2LiOH+H2↑。电池工作时,下列说法错误的是( )
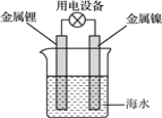
A.金属锂作负极
B.电子从锂电极经导线流向镍电极
C.海水作为电解质溶液
D.可将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6·SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。
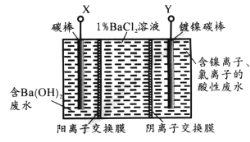
下列分析正确的是
A.X与电池的Li电极相连
B.电解过程中c(BaC12)保持不变
C.该锂离子电池正极反应为:FeS+2Li++2e =Fe +Li2S
D.若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业上有重要用途。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g) ![]() 2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为_________
2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为_________
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) ![]() 2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是______(填序号);
2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是______(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)在有氧条件下,新型催化剂M能催化![]() 与
与![]() 生成
生成![]() 。将一定比例的
。将一定比例的![]() 、
、![]() 和
和![]() 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
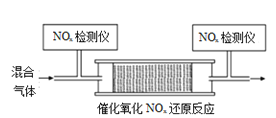
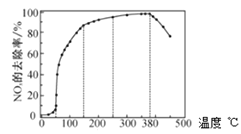
反应相同时间![]() 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在![]() 范围内随着温度的升高,
范围内随着温度的升高,![]() 的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使
的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使![]() 去除反应速率迅速增大,上升阶段缓慢主要是____________;当反应温度高于
去除反应速率迅速增大,上升阶段缓慢主要是____________;当反应温度高于![]() 时,
时,![]() 的去除率迅速下降的原因可能是_________。
的去除率迅速下降的原因可能是_________。
(4)如图为利用肼![]() —空气燃料电池电解硫酸铜溶液的示意图。
—空气燃料电池电解硫酸铜溶液的示意图。
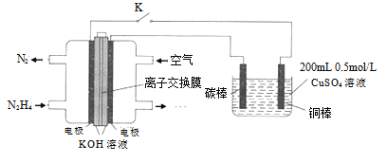
左图负极反应式为:___________。当上图阴极上放出2.24L气体![]() 标准状况
标准状况![]() 时,图中硫酸铜溶液的pH=______(溶液体积变化忽略不计)。
时,图中硫酸铜溶液的pH=______(溶液体积变化忽略不计)。
(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=_______mol·L-1·min-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=_______mol·L-1·min-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol金属钠和l mol氯气反应的能量关系如图所示,下列说法不正确的是:( )
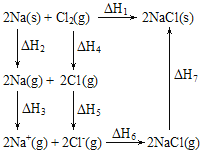
A.原子失电子为吸热过程,相同条件下,K(s)的(△H2'+△H3')<Na(s)的(△H2+△H3)
B.△H4的值数值上和Cl-Cl共价键的键能相等
C.△H2+△H3+△H4+△H5>-(△H6+△H7)
D.2Na(s)+Cl2(g)=2NaCl(s)在较低温度下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】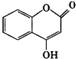 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成:
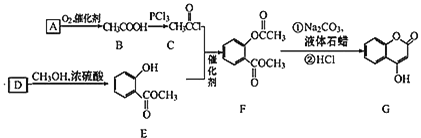
![]() 是一种气态烃,写出A的结构简式 ______ ;
是一种气态烃,写出A的结构简式 ______ ;
![]() 的反应类型是 ______ ;
的反应类型是 ______ ;
![]() 写出
写出![]() 的化学方程式 ______ ;
的化学方程式 ______ ;
![]() 下列关于G的说法正确的是 ______
下列关于G的说法正确的是 ______
![]() 能与溴单质反应
能与溴单质反应
![]() 能发生水解反应
能发生水解反应
![]() G最多能和5mol氢气反应
G最多能和5mol氢气反应
![]() 分子式是
分子式是![]()
![]() 写出满足以下条件的B的同系物所有同分异构体的结构简式 ______
写出满足以下条件的B的同系物所有同分异构体的结构简式 ______
![]() 分子式为
分子式为![]() 能发生银镜反应
能发生银镜反应![]() 能发生水解。
能发生水解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述溶液一定呈酸性的是
A.pH=6.8的溶液
B.滴入酚酞呈无色的溶液
C.室温时,溶液中的c(H+)=1×10-2 mol·L-1
D.溶液中水电离出的c(H+)=1×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是重要的有机化工原料,在有机合成中有着广泛的应用。
I.已知:烯烃复分解反应是指在催化剂作用下,实现![]() 两边基团换位的反应:2CH2=CHCH3
两边基团换位的反应:2CH2=CHCH3![]() CH3CH=CHCH3+CH2=CH2。经测定
CH3CH=CHCH3+CH2=CH2。经测定![]() 的一种同分异构体M的核磁共振氢谱有三个峰,峰面积之比为1:3:
的一种同分异构体M的核磁共振氢谱有三个峰,峰面积之比为1:3:![]() 下图为M合成Q的流程图。
下图为M合成Q的流程图。
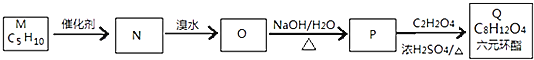
![]() 的名称为 ______ ;
的名称为 ______ ;
![]() 的化学反应类型为 ______ ;
的化学反应类型为 ______ ;
![]() 写出
写出![]() 的化学方程式 ______ 。
的化学方程式 ______ 。
![]() 有机物
有机物![]() 广泛用作香精的调香剂。实验室的科技人员利用M的一种同分异构体,通过下列流程合成有机物E。
广泛用作香精的调香剂。实验室的科技人员利用M的一种同分异构体,通过下列流程合成有机物E。
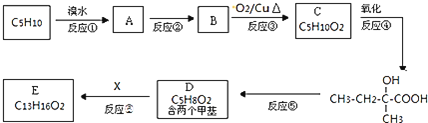
![]() 的化学方程式为 ______ ;
的化学方程式为 ______ ;
![]() 已知X的环上只有一个取代基,且取代基无支链,则E的结构简式为 ______ ;
已知X的环上只有一个取代基,且取代基无支链,则E的结构简式为 ______ ;
![]() 写出满足以下条件的X的同分异构体的结构简式: ______
写出满足以下条件的X的同分异构体的结构简式: ______
![]() 遇
遇![]() 溶液显紫色
溶液显紫色![]() 苯环上的一氯取代物只有两种。
苯环上的一氯取代物只有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
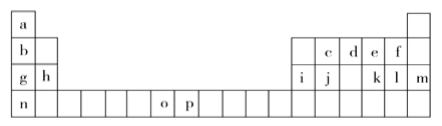
(1)基态o原子的外围电子排布图________________________;基态p3+的最外层电子排布式___________________;n的原子结构示意图____________________。在以上元素中,没有未成对电子的元素有______种。
(2)原子序数为52的元素x在元素周期表中与以上________________元素在同一族(填写以上表中字母对应的元素符号)。
(3)上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p),则I3(o)__I3(p)(填“>”或“<”)。理由是_________________________________________________。
(4)将以上周期表中g、h、i、j四种元素的电负性由大到小排序____________________(用元素符号表示),第一电离能由大到小排序________________________(用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com