
【题目】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) ==2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式_________________________________________________________
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下图所示.

①该反应第一次达到平衡时的平衡常数为________。
②第12min时改变的条件是________。
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将________移动(填“正向”、“逆向”或“不”).
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素。
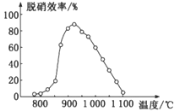
①SNCR脱硝技术中:在催化剂作用下用NH3作还原剂还原NO,其主要反应为:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0。体系温度直接影响SNCR技术的脱硝效率,如图所示。当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是________。
②SCR脱硝技术中则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________
【答案】2NO(g)+2CO(g) ![]() N2(g)+2CO2(g); △H=-746.5kJ/mol 0.35 L·mol-1 升温 逆向 低于925℃反应速率较慢,高于925℃ 会降低催化剂活性,且升高温度脱硝反应逆向移动 4CO(NH2)2+6NO2
N2(g)+2CO2(g); △H=-746.5kJ/mol 0.35 L·mol-1 升温 逆向 低于925℃反应速率较慢,高于925℃ 会降低催化剂活性,且升高温度脱硝反应逆向移动 4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O
4CO2+7N2+8H2O
【解析】
.(1)已知:CO燃烧热的△H1=283.0kJ/mol,热化学方程式:①CO(g)+1/2O2(g)=CO2(g); △H=83.0KJ/mol,
②N2(g)+O2(g)=2NO(g) ;△H1=+180.5kJ/mol,
盖斯定律计算①×2②得到2NO(g)+2CO(g)N2(g)+2CO2(g) △H;
(1)依据图象读出平衡浓度,结合平衡常数概念计算平衡常数;
(2)12min后反应物浓度增大,生成物浓度减小,说明平衡逆向进行;
(3)根据浓度商和平衡常数比较判断反应进行的方向;
(3)①用尿素[CO(NH2)2]作还原剂还原NO2的反应生成二氧化碳、氮气和水;
②SCR技术的反应温度不能太高,升温催化剂活性降低,当体系温度约为925℃C时,SNCR脱硝效率最高,SNCR技术脱硝的最佳温度选择925℃的理由是925℃时脱硝效率高,残留氨浓度较小。
(1)CO燃烧热的△H1=283.0kJ/mol,热化学方程式:①CO(g)+1/2O2(g)=CO2(g) ; △H=83.0KJ/mol,
②N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol,
盖斯定律计算①×2②得到2NO(g)+2CO(g)N2(g)+2CO2(g)△H=746.5kJ/mol,
故答案为:746.5kJ/mol;
(2) ①:依据图象分析,第一次达到平衡时时平衡状态下物质的浓度为c(NO)=0.16mol/L,c(CO)=0.06mol/L,c(N2)=0.02mol/L,c(CO2)=0.04mol/L,反应的平衡常数K=c(N2)c2(CO2)/[c2(NO)c2(CO)]=0.02×0.04×0.04/[0.16×0.16×0.06×0.06]=0.347Lmol1
故答案为:0.347Lmol1;
②12min后反应物浓度增大,生成物浓度减小,说明平衡逆向进行,反应是放热反应,升温改变符合图象变化;
故答案为:升温;因反应速率加快且反应逆向移动,对放热反应而言,改变条件为升温;
③24min时,各物质的浓度为c(NO)=0.18mol/L,c(CO)=0.08mol/L,c(N2)=0.01mol/L,c(CO2)=0.02mol/L,反应的平衡常数K=0.01×0.022/(0.182×0.082)=0.019,
若保持温度不变,此时再向容器中充入CO、N2各0.060mol,c(NO)=0.18mol/L,c(CO)=0.14mol/L,c(N2)=0.07mol/L,c(CO2)=0.02mol/L,浓度商计算Qc=0.07×0.022/[0.182×0.142]=0.044>K,平衡逆向进行,
故答案为:逆向;
(3)①图象可知SNCR技术的脱硝的最佳温度为:925℃左右,SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是 温度过高,催化剂活性降低,当体系温度低于900℃时,SNCR脱硝效率随温度升高而增大,反应速率较慢,当体系温度高于950℃时,SNCR脱硝效率明显降低,不利于脱硝反应正向进行。
②用尿素CO(NH2)2作还原剂还原NO2的化学方程式为:4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O。
4CO2+7N2+8H2O。
故答案为:(1)温度过高,催化剂活性降低;当体系温度低于900℃时,SNCR脱硝效率随温度升高而增大,反应速率较慢,当体系温度高于950℃时,SNCR脱硝效率明显降低,不利于脱硝反应正向进行。
(2)4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O;
4CO2+7N2+8H2O;
温度过高,催化剂活性降低;当体系温度低于900℃时,SNCR脱硝效率随温度升高而增大,反应速率较慢,当体系温度高于950℃时,SNCR脱硝效率明显降低,不利于脱硝反应正向进行。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】现有某铁碳合金(可看作铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中碳的质量分数,设计了如图所示的实验装置(夹持仪器已省略)。
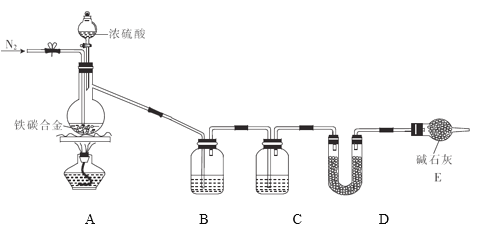
(1)装置A中发生的反应除外![]() ,还有________________。
,还有________________。
(2)请完成下列表格:
装置代号 | B | C | D |
所盛试剂 | 酸性 | ①________ | ②____________ |
装置作用 | ③_____________ | 干燥气体 | ④___________ |
(3)若铁碳合金的质量为5.00g,充分反应后称得D装置增重0.66g,则合金中碳的质量分数为_______,若缺少E装置,则所测碳的质量分数_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)N2(g)+2CO2(g),请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-l
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-l
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-l
则2NO(g)+2CO(g)N2(g)+2CO2(g)的△H=____kJ·mol-l。
(2)一定温度下,向体积为 1 L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1 mol,n(NO)=0.2 mol,n(N2)= a mol,且N2占平衡总体积的![]() 。
。
①则该反应的平衡常数K=______。若保持温度及容器体积不变,平衡后在此基础上再向容器中充入3a mol的N2、0.2 mol的NO,平衡将______移动(填“向左”、“向右”或“不”)。
②下列各种情况,可说明该反应已经达到平衡的是______。
A.v生成(CO2)= v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n molN≡N
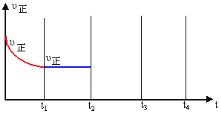
③在t2时刻,将容器迅速压缩到原容积的![]() ,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________。
,在其它条件不变的情况下, t3时刻达到新的平衡状态。请在图中补充画出t2-t3-t4时段,正反应速率的变化曲线_________。
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出上述变化中的总化学反应方程式_________。
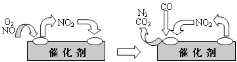
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
2SO3(g)△H = -196.0 kJ.mol-1,测得反应的相关数据如下,下列说法正确的是( )
容器1 | 容器2 | 容器3 | |
应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1mol O2 | 4mol SO3 | 2 mol SO3 |
平衡v正(SO2)/molL-1S-1 | v1 | v2 | v3 |
平衡c(SO3)/molL-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
反应能量变化 | 放出a KJ | 吸收b KJ | 吸收c KJ |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
A. v1< v2,c2<2c1B. K1> K3,p2>2p3
C.v1< v3,α1(SO2 ) <α2(SO3 ) D. c2>2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是 ( )
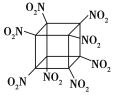
A. 分子中C、N间形成非极性键B. 1 mol该分子中含8 mol二氧化氮
C. 该物质既有氧化性又有还原性D. 该物质爆炸产物是NO2、CO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )

A.Mg和Al的总质量为8 g
B.原稀硫酸溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含硫酸铝和氯化铝的混合溶液中逐滴加入氢氧化钡溶液至过量,加入氢氧化钡溶液的体积和所得沉淀的物质的量的关系如图所示。
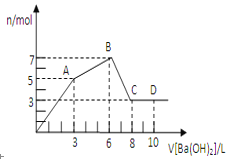
(1)氢氧化钡溶液浓度为_____________________。
(2)原混合溶液中SO42-和Cl-的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,向稀醋酸溶液中缓慢通入NH3,溶液中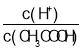 的值增大
的值增大
B.298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
C.标准状况下,将22.4 L Cl2通入足量NaOH溶液中,反应转移的电子数为2×6.02×1023
D.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4 mol A气体和4 mol B气体混合放入2 L的恒容密闭容器中,在一定条件下发生反应:2A(g)+2B(g)![]() C(g)+2D(g);经5min达到平衡, 测得体系中C的体积分数为1/9 ,下列说法中正确的是( )
C(g)+2D(g);经5min达到平衡, 测得体系中C的体积分数为1/9 ,下列说法中正确的是( )
A.D的平均速率为0.32mol/(L·min)
B.B的转化率为40%
C.增加B,B的平衡转化率升高
D.增大该体系的压强,平衡向右移动,化学平衡常数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com