
【题目】下列说法正确的是
A.常温下,向稀醋酸溶液中缓慢通入NH3,溶液中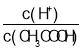 的值增大
的值增大
B.298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
C.标准状况下,将22.4 L Cl2通入足量NaOH溶液中,反应转移的电子数为2×6.02×1023
D.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
【答案】B
【解析】
A.对表达式稍作变形得到![]() ,因温度没变故K值不变,在通入氨气的过程中溶液逐渐变为醋酸铵溶液,醋酸铵是强电解质可以完全电离,因此溶液中的
,因温度没变故K值不变,在通入氨气的过程中溶液逐渐变为醋酸铵溶液,醋酸铵是强电解质可以完全电离,因此溶液中的![]() 在增大,则
在增大,则![]() 减小,A项错误;
减小,A项错误;
B.该反应是气体分子数减小的熵减反应,却能在室温下自发进行,说明其吉布斯自由能![]() 在298K时小于0,
在298K时小于0,![]() 必须为负才有可能实现,故反应放热,B项正确;
必须为负才有可能实现,故反应放热,B项正确;
C.氯气通入碱中发生歧化反应![]() ,标出化合价后不难发现1mol氯气在反应中只转移1mol电子,标况下22.4L氯气中有1mol氯气,则一共转移1mol电子,C项错误;
,标出化合价后不难发现1mol氯气在反应中只转移1mol电子,标况下22.4L氯气中有1mol氯气,则一共转移1mol电子,C项错误;
D.醋酸是弱酸,溶液中只有小部分醋酸分子能电离产生![]() ,因此相同
,因此相同![]() 浓度下的醋酸要比盐酸的浓度大,在中和等量
浓度下的醋酸要比盐酸的浓度大,在中和等量![]() 时需要的醋酸体积更少,D项错误;
时需要的醋酸体积更少,D项错误;
答案选B。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,H2SO3的电离常数:Ka1=1.54×102,Ka2=1×107。向mmL0.1mol/LH2SO3溶液中滴加0.1mol·L1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法不正确的是
A.m=10
B.c点对应的溶液中存在c(K+)>c(HSO3-)+2c(SO32)
C.b、d两点溶液的pH=7
D.SO32-+H2OHSO3-+OH的K=1×107
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) ==2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式_________________________________________________________
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下图所示.

①该反应第一次达到平衡时的平衡常数为________。
②第12min时改变的条件是________。
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将________移动(填“正向”、“逆向”或“不”).
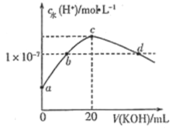
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素。
①SNCR脱硝技术中:在催化剂作用下用NH3作还原剂还原NO,其主要反应为:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0。体系温度直接影响SNCR技术的脱硝效率,如图所示。当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是________。
②SCR脱硝技术中则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子轨道排布图:_________________,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是________________________________________________________
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是___________(填序号)。
A.甲的金属性比乙强 B.乙有![]() 价
价
C.丙不可能为非金属元素 D.丁一定为金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
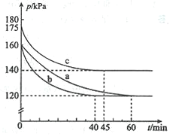
(1)列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)=________________。
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为_______________(填实验序号);与实验a相比,其他两组改变的实验条件是:b_________________、c____________________________________。
(3)用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为_________________;实验a和c的平衡转化率:αa为___________、αc为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
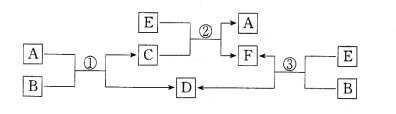
(1)若B是水,C是一种有磁性的黑色化合物,则反应①的化学方程式为_______。
(2)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环,反应①的离子方程式是______________________________________。在反应③中,若生成1 mo1 D,则转移电子数目为______________。
(3)若反应①、②、③均为水溶液中的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱的顺序为_________________,其中A的化学式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示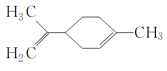 ,下列有关该有机物的说法正确的是( )
,下列有关该有机物的说法正确的是( )
A.该有机物的化学式为C10H14
B.它的一氯代物有6种
C.该有机物分子中所有的碳原子一定在同一平面上
D.一定条件下,它可以发生取代、加成、氧化和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由苯乙烯制备乙苯的反应原理为:![]() +H2―→
+H2―→![]() ,下列说法正确的是
,下列说法正确的是
A.苯乙烯和乙苯均能使溴的CCl4溶液褪色
B.乙苯中所有原子可能处于同一平面
C.等质量的苯乙烯和乙苯完全燃烧,苯乙烯消耗O2更多
D.乙苯的一氯代物有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,氧化性最强的单质是___,还原性最强的单质是___。
<>(2)最高价氧化物的水化物中碱性最强的是___,酸性最强的是___,呈两性的是___。(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___。
(4)在B、C、E、F、G、H中,原子半径最大的是___。
(5)用电子式表示B和H组成化合物的形成过程___,它属于___化合物(填“离子”或“共价”)。
(6)写出B的最高价氧化物的水化物和H的单质反应的离子方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com