
【题目】I. 用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
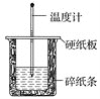
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。
(3)实验时所用盐酸及NaOH溶液的体积均为50 mL,各溶液密度均为1 g·mL-1,生成溶液的比热容c=4.18 J·g-1·℃-1,实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式ΔH=________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”或“无影响”)。
II.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | VmL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(2)若t1<8,则由此实验可以得出的结论是________________________________
【答案】环形玻璃搅拌棒 相等 -16.72(t2-t1)kJ·mol-1 偏小 浓度 1 293 B、C 3 其他条件相同时,增大反应物浓度,反应速率增大
【解析】
I.(1)由图可知,缺少环形玻璃搅拌棒;
(2)强酸强碱的稀溶液发生酸碱中和反应生成1mol水时放出的热量为中和热,中和热与酸或碱的用量无关;
(3)根据△H=![]() =
=![]() 进行计算;
进行计算;
(4)用氨水是弱电解质,电离时吸热,代替NaOH溶液进行实验,氨水反应时要吸收热量;
II.(1)实验A、B控制在相同的温度下,探究浓度对反应速率的影响,B、C在其他条件相同的情况下探究温度对发应速率的影响,据此回答问题;
(2)若t1<8,说明实验A比实验B反应速度更快。
I.(1)由图可知,缺少环形玻璃搅拌棒;
(2)中和热与酸或碱的用量无关,只要是强酸强碱的稀溶液反应生成1mol水,放出的热量就是相同的,因此所求中和热相等;
(3)△H=![]() =
=![]() =
=![]() =-16.72(t2-t1)kJ·mol-1;
=-16.72(t2-t1)kJ·mol-1;
(4)氨水反应时要吸收热量,导致测得的中和热的数值会偏小;
II.(1)实验A、B控制在相同的温度下,探究浓度对反应速率的影响,那么可知T1=293K,V1=1ml;B、C在其他条件相同的情况下探究温度对发应速率的影响,那么有V2=3ml;
(2)若t1<8,说明实验C比实验B反应速度更快,其他条件相同,增大反应物的浓度,反应速率加快。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是
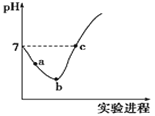
A.实验过程中用pH试纸测定溶液的pH
B.a~b段,溶液中![]() 减小
减小
C.b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-)
D.c点对应溶液中:c(Na+)=c(Cl-)+c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜改革国外的纯碱生产工艺,创造了侯德榜制碱法又叫联碱法,该法是将合成氨工厂生产的NH3及副产品CO2,再与饱和食盐水反应.
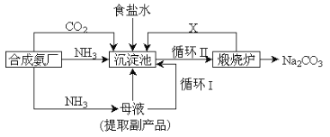
(1)该法与氨碱法比大大提高了原料利用率,主要表现在_______。
(2)碳酸氢钠分解产生的二氧化碳可循环使用,但必须要补充,补充的主要原因是_________,但实际生产中补充量超过理论上反应耗用量,可能的原因是______。
(3)氨碱法需补充的二氧化碳一定来自_________。那么联合制碱需补充的二氧化碳可能来自__________。
(4)侯德榜法在滤去碳酸氢钠的母液中通氨气并加入细小食盐颗粒,冷却析出副产品,通氨气的作用____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组欲探究己烷的性质,用己烷进行下列实验:
实验1:
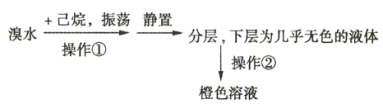
实验2:将上述橙色溶液装入密封性好的无色试剂瓶中。过一段时间,溶液颜色变浅,打开瓶盖瓶口出现白雾。
实验3:利用如图所示实验装置在一定条件分解己烷(生成丙烷和丙烯![]() ),且丙烯能被酸性
),且丙烯能被酸性![]() 溶液氧化。
溶液氧化。
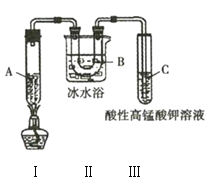
(1)实验1中用到的玻璃仪器主要有______________________________________(填名称)。
(2)由实验1可知,己烷的物理性质有____________________________________。
(3)实验2中的橙色溶液逐渐变浅的原因是__________________(填序号)。
A.己烷与溴发生了取代反应
B.溴代己烷为无色物质
C.液溴向外挥发浓度降低
D.己烷与液溴发生了加成反应
E.液溴与己烷分层,密度大的液溴在下层
(4)实验3中装置Ⅱ的作用是______________________________________。
(5)试管C中的现象是______________________________________。
(6)试写出装置Ⅰ中发生的生成丙烷和丙烯的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.写出下列反应的热化学方程式。
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_____________________。
(2)在1.01×105 Pa时,16 g S固体在足量的氧气中充分燃烧生成二氧化硫,放出148.5 kJ的热量,则S固体燃烧热的热化学方程式为________________________。
II.研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(3)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S固体。已知:
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是_____________________。
(4)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为______________kJ(用含有a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应为N2(g)+3H2(g) ![]() 2NH3(g),对其研究如下:
2NH3(g),对其研究如下:
(1)已知H—H键的键能为436 kJ·mol-1,N—H键的键能为391 kJ·mol-1,N≡N键的键能是945.6 kJ·mol-1,则上述反应的ΔH=_________________________。
(2)上述反应的平衡常数K的表达式为_______________________________。
若反应方程式改写为![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g),在该温度下的平衡常数K1=_________(用K表示)。
NH3(g),在该温度下的平衡常数K1=_________(用K表示)。
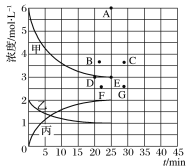
(3)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正________(填“大于”、“小于”或“等于”)v逆。
②由上表中的实验数据计算得到“浓度时间”的关系可用下图中的曲线表示,表示c(N2)t的曲线是_____。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)t的曲线上相应的点为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸锶可用于制造烟火及信号弹等。工业级硝酸锶![]() 含
含![]() 、
、![]() 等杂质
等杂质![]() 的提纯流程如下。
的提纯流程如下。![]() 已知:硝酸锶、硝酸钡不溶于浓硝酸
已知:硝酸锶、硝酸钡不溶于浓硝酸![]()
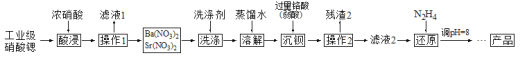
![]() 要加快“酸浸”速率所采取的措施是_________
要加快“酸浸”速率所采取的措施是_________![]() 写一条即可
写一条即可![]() 。
。
![]() 操作1的名称是 _____________,洗涤所用的洗涤剂是 ________。
操作1的名称是 _____________,洗涤所用的洗涤剂是 ________。
![]() “滤液2”中过量的
“滤液2”中过量的![]() 被
被![]() 还原为
还原为![]() ,同时放出无污染的气体,写出发生反应的离子方程式 _________;氧化产物与还原产物的物质的量之比为 _________。
,同时放出无污染的气体,写出发生反应的离子方程式 _________;氧化产物与还原产物的物质的量之比为 _________。
![]() 已知
已知![]() 不溶于水,还原后调节
不溶于水,还原后调节![]() 的目的是 ________。
的目的是 ________。
![]() 为了测定“残渣2”中Cr元素的质量分数,进行以下实验。
为了测定“残渣2”中Cr元素的质量分数,进行以下实验。![]() 已知:
已知:![]() 残渣
残渣![]()
![]() “残渣2”中Cr元素的质量分数为 _______
“残渣2”中Cr元素的质量分数为 _______![]() 用代数式表示
用代数式表示![]() 。
。
![]() 若加入的HI溶液过量太多,测定结果会是 ________
若加入的HI溶液过量太多,测定结果会是 ________![]() 填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响”![]() ,其原因是 ______。
,其原因是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,一定不能自发进行的是( )
A. 2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS=1110 J/(mol·K)
B. CO(g)===C(s,石墨)+![]() O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3kJ/mol ΔS=-280.1 J/(mol·K)
D. NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=37.301kJ/mol ΔS=184.05 J/(mol·K)
查看答案和解析>>
科目:高中化学 来源: 题型:
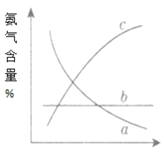
【题目】N2+3H2![]() 2NH3合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
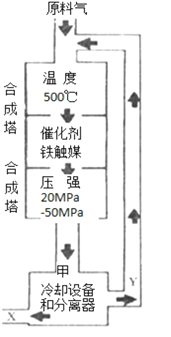
①X的化学式为___;
②图中条件选定的主要原因是(选填字母序号)___;
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。如图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母代号)___,当横坐标为温度时,变化趋势正确的是(选填字母序号)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com