
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 228.64 |
| 285.8 |
| ||
| ||
| 1.28g |
| 64g/mol |
| ||
| 0.04mol×2 |
| 0.4L |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
| A、Mg2+、NH4+、K+、SO42- |
| B、Na+、S2O32-、OH-、Br- |
| C、Na+、K+、NO3-、SO42- |
| D、K+、Cr2O72-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
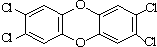 1999年比利时发生奶粉受二噁英污染事件.二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图.下列说法中不正确的是( )
1999年比利时发生奶粉受二噁英污染事件.二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.2,3,7,8-四氯二苯并二噁英是其中的一种,结构如图.下列说法中不正确的是( )| A、它的分子式为C12H4O2Cl4 |
| B、它的一溴取代物有一种 |
| C、它能发生取代反应 |
| D、此分子中共平面的原子最多有18个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水中形成的分散系属于悬浊液 |
| B、分子直径比Na+小 |
| C、“钴酞菁”分子不能透过滤纸 |
| D、在水中形成的分散系具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2升 |
| B、67.2升 |
| C、4.48升 |
| D、33.6升 |
查看答案和解析>>
科目:高中化学 来源: 题型:
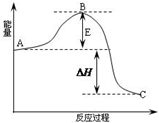 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
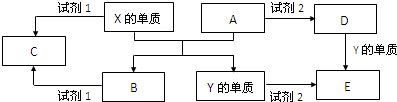
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com