
【题目】全钒液流储能电池一次性充电后,续航能力可达1000 km,而充电时间只需3~5 min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是( )
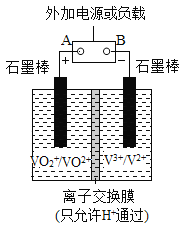
A. 放电时的正极反应为V3++e-=V2+
B. 放电过程中,右槽溶液由紫色变为绿色
C. 充电时的电流方向由B电极流向A电极
D. 充电时的阴极反应为VO2++2H++e-=VO2++H2O
【答案】B
【解析】
电池放电时,左槽溶液质量增加,由于离子交换膜只允许氢离子通过,则放电时,氢离子向左槽移动,即左槽为正极,正极上发生得电子的还原反应,即VO2++2H++e-═VO2++H2O,右槽为负极,负极发生失电子的氧化反应,即V2+-e-═V3+;充电时,左槽为阳极,VO2+失电子生成VO2+,右槽为阴极,V3+得电子生成V2+,据此分析。
A.放电时,氢离子向左槽移动,即左槽为正极,正极上发生得电子的还原反应,即VO2++2H++e-═VO2++H2O,故A错误;B.放电时,该装置为原电池,左槽作正极,右槽作负极,负极发生失电子的氧化反应,即V2+-e-═V3+,则溶液由紫色变为绿色,故B正确; C.放电时左槽为正极,即A为正极,则充电时A连接电源的正极,B极连接电源的负极,电流由A到B,故C错误;D.充电时,右槽为阴极,阴极上V3+得电子生成V2+,即V3++e-═V2+,故D错误;故答案为B。


科目:高中化学 来源: 题型:
【题目】有机化合物A~H的转换关系如下所示:

请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是____________________________。
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。E______(填“存在”或“不存在”)顺反异构,由E转化为F的化学方程式为______________________________。
(3)G与金属钠反应能放出气体,由F转化为G的反应条件是__________________;由G生成H的化学方程式是__________________。
(4)B是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构),则B的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。则下列说法正确的是

A. 通常情况下,NO比N2稳定
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1molN2(g)和1molO2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 1molN2(g)和1molO2(g)反应放出的能量为180kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在初始温度为500 ℃的绝热恒容密闭容器中,充入1 mol HI发生如下反应:2HI(g)![]() H2(g)+I2(g)。能说明该反应达到平衡的是( )
H2(g)+I2(g)。能说明该反应达到平衡的是( )
A. HI的生成速率是I2 消耗速率的2倍
B. 平衡常数不再改变
C. 气体密度不再改变
D. 容器内气体质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,不同酸性条件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是

A. 随着溶液pH增大,![]() 不断增大
不断增大
B. 由水电离出的c(H+):Q>X=Y
C. HF的电离常数Ka=1.0×10-3.2
D. 0.1 mol/LNaF溶液的pH约为8.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:

(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g) ![]() 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知:
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是
A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铝是某种高效净水剂的主要成分,实验室利用铝土矿(主要含Al2O3,还含少量Fe2O3、SiO2等杂质)制取碱式氯化铝的过程如下:
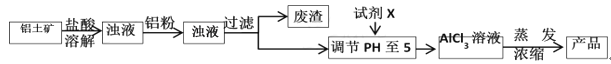
(1)溶解铝土矿需要使用质量分数为15%的盐酸,配制该盐酸所需的玻璃仪器有________
(2)盐酸溶解铝土矿的过程中,发生反应的离子方程式为____________(写一个即可),其目的是__________________________________________________________。
(3)从不引入杂质去考虑,调节溶液的pH时加入的物质最好为__________(填序号)。
A.NaOH B.Al C.氨水 D.Al2O3
(4)写出用pH试纸测定加入试剂X后所得溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸,________________________________________________,得出被测液的pH。
(5)实验室利用盐酸与大理石制取CO2的实验装置如图所示:
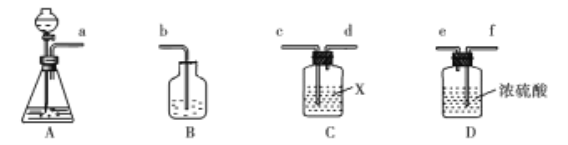
则各装置中导管从左到右的连接顺序为_________,装置C中盛放的试剂X为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com