
 NO(g)+6H2O(g) △H=-bkJ/mol
NO(g)+6H2O(g) △H=-bkJ/mol 则N2(g)+3H2(g) 2NH3(g)的△H= ;
则N2(g)+3H2(g) 2NH3(g)的△H= ;科目:高中化学 来源:不详 题型:单选题
| A.H3BO3的酸性与H2CO3的酸性 |
| B.向Ag2CrO4浑浊液中加NaCl溶液,有AgCl沉淀生成,Ksp (Ag2CrO4) 与Ksp(AgCl) |
| C.I2在KI溶液中和在水中的溶解度 |
| D.相同温度下,lO ml O.l mol·l一的醋酸与100 ml O.01 mol·L一的醋酸中的H+物质的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2(g
N2(g )+O2(g)
)+O2(g) 2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
2NO(g) △H=a kJ·mol-1的平衡常数K如下表:| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0、86×10-4 | 2、6×10-4 | 64×10-4 |
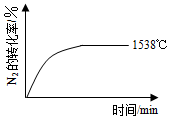
 程式如下:
程式如下: (g)+3O2(g) △H=+1530kJ·mol-1
(g)+3O2(g) △H=+1530kJ·mol-1 研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2
研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2 2NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
 (4)合成氨的反应N2(g)+3H2(g)
(4)合成氨的反应N2(g)+3H2(g)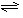 2NH3(g) △H = -92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
2NH3(g) △H = -92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。 (5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”),可推断a 0、01(填大于、等于或小于)。
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”),可推断a 0、01(填大于、等于或小于)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.纯锌与稀硫酸反应时,为加快速率可滴入少量硫酸铜溶液 |
| B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 |
| C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| D.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 为例)、人工固氮(以
为例)、人工固氮(以 为
为 的值如下表。
的值如下表。


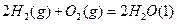

 可以与水反应,则反应
可以与水反应,则反应 +
+ =
= +3/2
+3/2 的
的

 的
的 ,
, 和
和 随时间变化的关系如图所示。
随时间变化的关系如图所示。 将增大
将增大 的浓度变化表示)v(
的浓度变化表示)v( )= .
)= . =
= ,则反应的平衡常数K=(用代数式表示).
,则反应的平衡常数K=(用代数式表示).查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
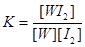
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①③④ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O (g ).在其它
CH3OH(g)+H2O (g ).在其它 条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com